
某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%.
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
| 所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
| 加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
| 烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
解析试题分析:盐酸完全反应时,生成二氧化碳的质量为100 g﹢11.2 g﹣106.8 g﹦4.4 g.
设:纯碱产品中碳酸钠质量为x,稀盐酸中溶质的质量为y,生成氯化钠的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4 g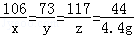
x="10.6" g y="7.3" g z="11.7" g
(1)纯碱产品中碳酸钠的质量分数=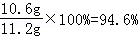 标注不真实.
标注不真实.
(2)盐酸溶液中溶质质量分数=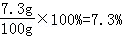
(3)氯化钠溶液中溶质质量分数=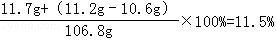
答:(1)该纯碱产品中碳酸钠质量分数的标注不真实.
(2)所用盐酸溶液中溶质的质量分数为7.3%.
(3)恰好完全反应时,所得溶液中溶质的质量分数为11.5%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:计算题
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量。他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如下表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的碱会含有少量的NaCl.某研究性学习小组称取含NaCl的Na2CO3,固体25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8g二氧化碳气体.试计算:(1)原固体中Na2CO3,的质量分数;(2)反应中消耗的盐酸的总质量
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
过氧化氢溶液在存放过程中会自然分解,使溶质质量分数减小.某同学使用一瓶原标注为30%的过氧化氢溶液完成制取氧气的实验.通过称量,该瓶中共有116.8g溶液,取出13.6g在一定条件下进行实验,发现生成气体的质量与反应时间的关系如图所示.试计算
(1)现在这瓶过氧化氢溶液的溶质质量分数.
(2)该瓶溶液中,已经分解的过氧化氢质量.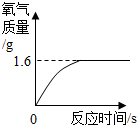
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在2013年我市中考化学实验考试中,小华同学抽到的题目是“二氧化碳的制取和性质”。小华熟练地取一定量的石灰石与足量稀盐酸反应,产生二氧化碳气体。请计算小华制得1.76二氧化碳,至少需要80%的石灰石的质量(假设石灰石中杂质不与稀盐酸反应)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。 
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填字母编号)。
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优是 。
用乙装置完成“制取并检验CO2”的实验,消耗了含0.1克碳酸钙的石灰石。请计算实验过程中产生CO2的质量是多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: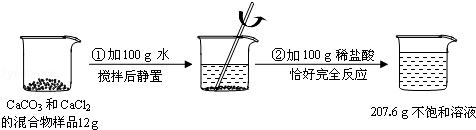
(1)原混合物样品中CaCl2的质量是多少?
(2)实验所用稀盐酸的溶质的质量分数是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com