
【题目】下图是甲、乙两种物质的溶解度曲线。
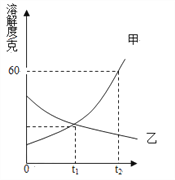
⑴溶解度随温度的升高而减小的物质是________________。
⑵t1℃时,甲、乙两种物质的溶解度________________。
⑶要使乙的饱和溶液变为不饱和溶液,除加水之外还可采取的方法是________________。
⑷t2℃时,甲的饱和溶液中溶质的质量分数是_______。
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:初中化学 来源: 题型:
【题目】请按要求回答下列问题:
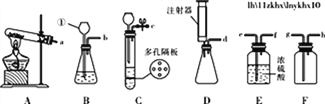
⑴写出仪器①的名称________;
⑵要组装一套“随开随用,随关随停”制取干燥二氧化碳的实验装置,选择装置的接口顺序是_____(填接口序号);
⑶若选择装置A制氧气,反应的化学方程式为____________;
⑷乙炔(C2H2)俗称电石气,是一种无色无味气体,密度比空气略小,难溶于水。实验室常用块状碳化钙(CaC2)与水反应制乙炔,同时有氢氧化钙生成,该反应非常剧烈。从上图中选择实验室制乙炔所用的最佳发生装置是________(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了比较镁、铜、铁三种金属的活动性强弱,兴趣小组的同学用这三种金属分别 与稀硫酸和硝酸银溶液反应。
①能否根据镁、铜、铁与硝酸银溶液反应的结果来判断三种金属的活动性强弱?
_____(选填“能”或“不能”),写出铜和硝酸银溶液反应的化学方程式_________________② 金属锌、铜、铁的活动性由强到弱的顺序是_________________。(用元素符号表示)
(3)铝热剂是修建铁路时常用的焊接材料,其反应原理是在高温下,铝与氧化铁反 应得到熔融的铁与一种氧化物。该反应的化学方程式为________________。
(4)将一定量的镁粉加入到硝酸银、硝酸铜的混合溶液中,充分反应后过滤,向滤渣 中加入盐酸无气泡产生,则下列叙述中完全正确的组合是______________
①滤渣中一定含有银,一定不含有铜
②滤液中的溶质一定含有硝酸镁,一定不含有硝酸银
③若滤液为蓝色,则滤液中的溶质一定含有硝酸铜和硝酸镁
④若滤液为无色,则滤渣中一定含有银和铜,滤液中的溶质一定只含有硝酸锌
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1是甲、乙两种物质的溶解度曲线。20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到图2所示的现象。下列说法正确的是
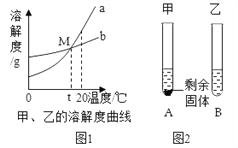
A. 20℃时,乙溶液是饱和溶液
B. t℃后乙溶解度大于甲的溶解度
C. 升高温度可使两试管中甲、乙溶液的质量分数均增大
D. 从20℃降低到t℃时,甲、乙两物质的溶解度相等,两试管中甲溶液溶质质量分数与乙溶液相等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。现以黄铁矿为原料生产硫酸,工艺流程如图所示
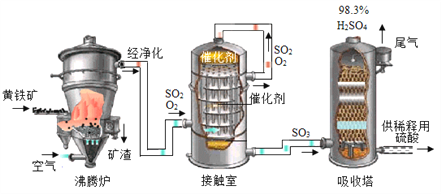
(查阅资料)![]()
(1) 接触室中发生反应的化学方程式为________________。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是________g,稀释时,应将______沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,请写出稀硫酸的一种用途____________。
(2) 依据生产硫酸的工艺流程图,下列说法正确的是_____________(填字母).
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.SO2可作为生产硫酸的原料再利用 D.沸腾炉排出的矿渣可供炼铁.
(3) 化学兴趣活动小组称取1.6g黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,最终B锥形瓶中增重1.28g.
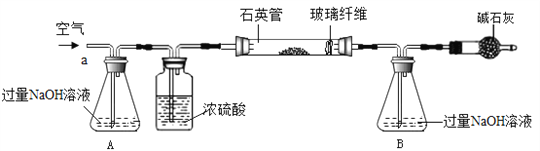
①A中NaOH溶液的作用____________________________。
②计算该黄铁矿中FeS2的质量分数___________。(假设每步反应均完全)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线.
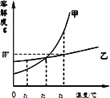
(1)t1℃时,甲的溶解度____乙的溶解度(选填“大于”“等于”或“小于”);
(2)要使接近饱和的甲溶液变为饱和溶液,可采取的方法是_________________(只填一种);
(3)甲、乙各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌,在t3℃时所得乙溶液为______溶液(选填“饱和”或“不饱和”);若将温度都降低到t2℃,甲溶液中溶质的质量分数______乙溶液中溶质的质量分数(选填“大于”“等于”或“小于”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如下图所示。
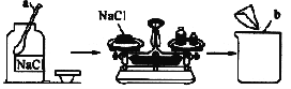
试回答下列问题:
(1)写出图中有标号仪器的名称:![]() ____________,
____________,![]() ____________。
____________。
(2)图示实验中有一处明显的错误是_______________________________________________;
图示实验中玻璃棒的作用是________________________________________________。
(3)小刚同学要配制90g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为__________g,需要量取水的体积为________ml(水的密度近似看作1g/ml)。
(4)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量________(填“大于”或“小于”)配制溶液所需的质量。
(5)在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
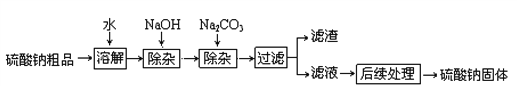
(1)滤渣中两种主要成分的化学式为 ________、____________。
(2)NaOH和Na2CO3如果添加过量了,可加入适量__________溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______选填字母)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某食品包装袋中“双吸剂”标签如图所示:同学们对这包久置的“双吸剂”样品很感兴趣,设计下列实验进行探究。

(提出问题)久置的“双吸剂”固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下反应生成氯化亚铁:Fe+2FeCl3=3FeCl2
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
(定性研究)小明取少量样品放入试管中,加入一定量的稀盐酸,发现:试管中固体质量逐渐减少,生成一种能使澄清石灰水变浑浊的气体,得到浅绿色溶液。他初步判断:样品中一定含有__________,一定不含Fe2O3。
(实验质疑)小组同学讨论认为上述实验并不能得出一定不含Fe2O3的结论,理由是 _____,_________(用化学方程式表示)。
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量实验。
(定量研究)取3g样品研碎,并用磁铁充分吸收后,得到剩余固体2.6g,按照下列流程进行实验,请回答相关问题:

⑴ 操作二、操作三的名称是__________。
⑵ 固体I的成分是_________(填化学式,下同)
⑶ 写出生成固体II的化学方程式__________。
⑷ 依据定性、定量研究中现象的分析及有关数据计算判断,这包久置的“双吸剂”固体的成分中氧化钙的质量小于_____。
(实验反思)结合上面的实验,下列说法正确的是______(填字母序号)
a.对物质成分的研究有时需要定性和定量相结合
b.在原样品中加入足量盐酸有4个反应发生
c.定量研究烧杯C中的溶质为NaOH和Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com