
【题目】如图是甲、乙两种固体物质的溶解度曲线.
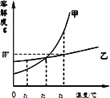
(1)t1℃时,甲的溶解度____乙的溶解度(选填“大于”“等于”或“小于”);
(2)要使接近饱和的甲溶液变为饱和溶液,可采取的方法是_________________(只填一种);
(3)甲、乙各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌,在t3℃时所得乙溶液为______溶液(选填“饱和”或“不饱和”);若将温度都降低到t2℃,甲溶液中溶质的质量分数______乙溶液中溶质的质量分数(选填“大于”“等于”或“小于”).
科目:初中化学 来源: 题型:
【题目】实验室里有许多矿石标本,其中的四种矿石及其主要成分如下:

(1)上述矿石标本的主要成分中,所含元素种类最多的是_________(填字母序号)。
(2)某地炼铁厂以赤铁矿、焦炭、石灰石等为原料,冶炼得到的产品是生铁,生铁属于_______(填“纯净物”或“混合物”)。铁锈的主要成分也含有Fe2O3,铁生锈是铁与____共同作用结果。日常生活中防止铁锅生锈可采取的措施是____________。
(3)白钨矿可冶炼金属钨。钨可用于制灯泡的灯丝,是因为钨具有____的物理性质。
(4)石英矿和沙子都含有二氧化硅,可用来制取单质硅。
①工业制取粗硅的化学方程式为:SiO2+2C![]() Si+2CO↑,该反应的基本类型为______。
Si+2CO↑,该反应的基本类型为______。
②硅在O2中燃烧生成SiO2,并放出大量热,科学家正研究将硅作为新能源。与化石能源相比较,硅燃烧没有CO2排放,因而有助于解决的环境问题是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重点。
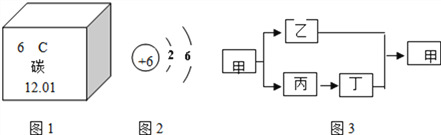
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少________(填化学式)的排放量.
(2)图1为元素周期表中的一格,下列说法不正确的是________(填标号)
A.碳元素属于非金属元素 B.碳原子核内质子数为6
C.碳元素的原子结构示意图为图2 D.碳的相对原子质量是12.01
(3)甲乙丙丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂.它们之间有如图3所示的转化关系(部分物质和反应条件已略去).则甲的化学式为________;甲转化为乙丙的化学方程式为_________________,属______反应(填基本反应类型);乙+丁→甲的方程式为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E分别表示初中化学常见的五种物质,它们的部分反应和转化关系如图所示。( “![]() ”表示两种物质间能发生反应,“
”表示两种物质间能发生反应,“![]() ”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。
”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。
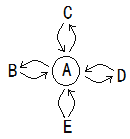
(1) 常温下,若A为一种气态氧化物,且A与B的相互转化能实现自然界中的碳氧循环, C可用于制玻璃,俗称纯碱,E是单质。A的固体俗称_____,C的化学式为__,D的用途_______(只说一点)。A转化为B的化学方程式_______。
(2) 若A为生活中使用最广泛的金属,且E不能转化为A,其它关系不变,C由两种元素组成,其溶液为浅绿色,E是无色溶液,与A、C反应时都能产生明显现象,D是黑色固体,B是一种气体单质,B与D可以反应生成A和水。
① 写出A![]() D的化学方程式:____________。
D的化学方程式:____________。
② B与D的反应属于_____________________ (填基本反应类型)
③ E 中溶质的化学式为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种物质的溶解度曲线。
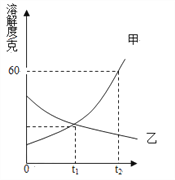
⑴溶解度随温度的升高而减小的物质是________________。
⑵t1℃时,甲、乙两种物质的溶解度________________。
⑶要使乙的饱和溶液变为不饱和溶液,除加水之外还可采取的方法是________________。
⑷t2℃时,甲的饱和溶液中溶质的质量分数是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图表示的是KNO3和NaNO3的溶解度曲线。下列说法正确的是( )
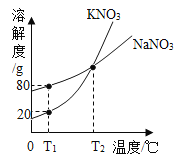
A. T2℃时,KNO3溶液的浓度一定等于NaNO3溶液的浓度
B. T1℃时,在50g水里加入15gKNO3固体,充分溶解,可得到65g溶液
C. 若KNO3中混有少量NaNO3,可用蒸发溶剂的方法提纯
D. T1℃时,往180gNaNO3饱和溶液中加入620g水可配成质量分数为10%的NaNO3溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:(请你在横线上填写所缺的金属的元素符号)
K Ca NaMg Al__FeSnPb(H) Cu Hg __Pt Au
【作出猜想】
猜想1:Fe>Cu>Cr
猜想2:Fe>Cr>Cu
(你的猜想)猜想3:________________。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,在常温下分别放入等量的同种浓度的稀硫酸中。请填写试管3中的实验现象
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | ________ |
【结论与解释】
(1)小聪得到的结论是猜想_________正确。
(2)实验前用砂纸打磨金属片的目的是___________________________________________。
【知识运用】将铬片投入FeSO4溶液中,反应________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式:___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到_________________,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
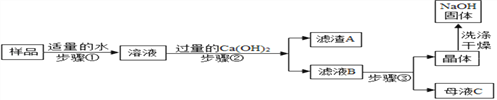
[实验分析]:
⑴步骤②反应的化学方程式是____________,步骤②的操作有搅拌和过滤,搅拌的作用是_______.
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是_________.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、_________、过滤. A.蒸发结晶B.降温结晶
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是_______________.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
⑸表中第_________次恰好完全反应.
⑹请计算样品中氢氧化钠的质量分数为_____________?(请写具体解题过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像与对应选项关系合理的是( )
A. 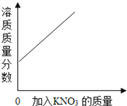 在某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
在某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B. 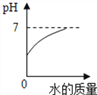 向氢氧化钠溶液中不断加水
向氢氧化钠溶液中不断加水
C. 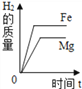 将等质量的镁粉和铁粉投入到足量稀盐酸中
将等质量的镁粉和铁粉投入到足量稀盐酸中
D. 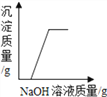 向硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
向硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com