
【题目】甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题
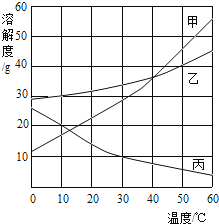
(1)50℃时,将40g乙物质放入50g水中充分溶解后,得到的溶液质量为_____g
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为_____
(3)请写出一种符合丙曲线变化趋势的物质_____(填俗名)
(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是_____。
(5)要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是_____。
【答案】70g 乙>甲>丙 熟石灰 丙 小于30℃
【解析】
(1)50℃时,乙物质的溶解度是40g,所以将40g乙物质放入50g水中充分溶解后,得到的溶液质量为70g;
(2)通过分析溶解度曲线可知,20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为:乙>甲>丙;
(3)丙物质曲线变化趋势是随温度的升高而减小,所以该物质可以是:熟石灰;
(4)甲、乙物质的溶解度随温度的降低而减小,丙物质的溶解度随温度的升高而增大,10℃时甲、乙物质的溶解度大于50℃时丙物质的溶解度,所以50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是丙;
(5)30℃时,丙物质的溶解度是10g,所以饱和溶液的质量分数为:![]() ×100%≈9.1%,要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是小于30℃。
×100%≈9.1%,要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是小于30℃。
故答案为:(1)70g;(2)乙>甲>丙;(3)熟石灰;(4)丙;(5)小于30℃。


科目:初中化学 来源: 题型:
【题目】模型是联系宏观与微观的桥梁。
(1)如图是钠原子结构示意图。
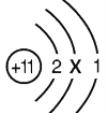
①X的数值为_________________。
②“11”指的是_________________。
③钠原子在化学反应中易失去1个电子,形成_______(填离子符号)。
(2)下图是氢分子和氧分子运动的示意图。

①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是__________(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与______________________有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2022年第24届冬季奥林匹克运动会将在我国北京-张家口举办。
(1)下列冬奥会事项与化学无关的是_____________
A 研制新型材料用于场馆建设 B 在短道速滑的冰道上洒水减少摩擦
C 用消毒剂处理奥运村生活污水 D 用清洁能源做汽车燃料接送运动员

(2)造雪机的工作原理如图所示。A处空气被压缩,体积变小。从微粒的角度解释其原因是__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组对粗盐进行提纯,并配制NaCl溶液。实验流程如下图:
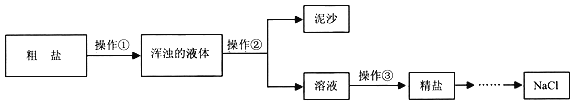
(1)操作③的名称是_________。
(2)操作①②③都要用到的一种玻璃仪器是______,在操作②中,这种玻璃仪器的作用是_____
(3)计算精盐的产率,结果偏低,可能的原因是______(写一种)。
(4)配制100g6%的NaCl溶液,若实际配得的溶液溶质质量分数偏大,可能的原因是____(填标号)。
a 称量NaCl所用天平砝码已生锈 b 用量筒取水时俯视读数
c 用量筒取水时仰视读数 d 用残留蒸馏水的烧杯配制溶液
(5)欲配制20g质量分数为3%的NaCl溶液,需要6%的NaCl溶液________mL(假设NaCl溶液的密度均为1.0g·cm-3)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 上述图象表示碳酸钠的溶解度曲线
B. 20℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D. 40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】不少家庭养观赏鱼,有时会在鱼缸里放点鱼浮灵,可使水中的含氧量迅速增加,能有效提高鱼的成活率,并且有杀菌作用。某小组对鱼浮灵成份及原理进行了相关探究。
(实验1)检验气体
查阅资料1:鱼浮灵化学名称是过氧碳酸钠(xNa2CO3yH2O2),常温下,过氧碳酸钠易溶于水并迅速放出氧气。
实验方案1::在一支试管中加入适量的鱼浮灵,____________(将后续操作及现象补充完整),证明产生的气体是氧气。
(实验2)检验反应后溶液中的溶质成分
猜想假设:猜想1:Na2CO3 猜想2:Na2CO3和NaOH
查阅资料2:用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
NaOH溶液 | Na2CO3溶液 | |
滴加酚酞溶液 | 现象 | 现象 |
加入稀盐酸 | 无明显现象 | 现象 |
加入澄清石灰水 | 无明显现象 | 现象 |
加入 1%的CaCl2溶液 | 溶液变浑浊 | 溶液变浑浊 |
加入 0.1%的CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
表中的现象 _______(填序号)为溶液变红色,现象③对应的化学反应方程式为____。
实验方案 2:同学们取实验 1 反应后的溶液于试管中,加入过量_____(填“1%”或“0.1%”)的 CaCl 2 溶液,充分反应后过滤,取少量滤液,向滤液中滴加无色酚酞溶液,观察到滤液呈 _______色,证明猜想 1 正确。
(反思拓展) 根据上述探究可知,保存鱼浮灵时应注意___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示的四个图象分别对应四种过程,其中正确的是( )
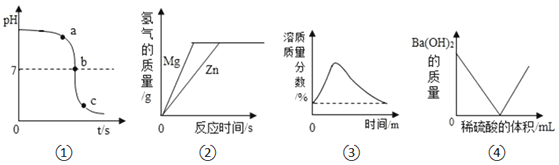
A. ![]() 将NaOH溶液逐滴滴加到盛有稀
将NaOH溶液逐滴滴加到盛有稀![]() 的烧杯中
的烧杯中
B. ![]() 分别向等质量且足量的Mg和Zn中加入等质量,等浓度的稀硫酸
分别向等质量且足量的Mg和Zn中加入等质量,等浓度的稀硫酸
C. ![]() 室温时,向一定量的饱和石灰水中加入少量氧化钙
室温时,向一定量的饱和石灰水中加入少量氧化钙
D. ![]() 向
向![]() 溶液中逐滴加入稀硫酸
溶液中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面相关信息,根据要求回答问题:
铁是目前世界上应用最广泛的金属,年产量位居第一。无论是日常生活用品,还是工农业生产或其他领域,都离不开铁。实验室中常用的还原铁粉,灰色或黑色粉末,又称“双吸剂”,常用于食品保鲜。还原铁粉一般由四氧化三铁在高温条件下,通入一氧化碳气流还原生成,其主要成分为结构疏松的单质铁,由于还原铁粉本身已是粉末状,再加之其微观结构又十分疏松,所以其应用更加广泛;另外,还原铁粉在化工生产及实验室作业中常用作优质还原剂。
(1)常见的铁制品大多是生铁或钢、不锈钢制成的,生铁和钢都是铁的_____。
(2)铁常被用来压成薄片或拉成细丝,这主要利用了铁的_____性。
(3)还原铁粉常用于食品保鲜,主要是因为能够吸收空气中的_____。
(4)在实验室中,用等质量的细铁丝和还原铁粉分别与等体积、等溶质质量分数的稀盐酸反应,还原铁粉与稀盐酸的反应更剧烈,原因是_____。
(5)用四氧化三铁制取还原铁粉的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在氢氧化钠溶液和稀盐酸的反应中,小明和老师用数字化设备测定了溶液温度及pH值随时间变化变化的关系曲线图。
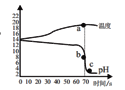
(1)根据曲线图,可知该实验是将_______(选填“氢氧化钠溶液”或“稀盐酸”)滴加到另外一种试剂中。该反应为___________。
A 吸热反应 B 放热反应
(2)a为温度曲线上的最高点,a、b两点对应的时间相同,则b对应的纵坐标数值为____。
(3)分别取样,依次进行以下实验:
①将b点处溶液中的溶质结晶,采用__________方法。
②取c点样品于试管中,加足量水稀释后溶液的pH__________7(填“>”、“<”或“=”)。
(4)若发现氢氧化钠溶液试剂瓶敞口放置,经检验该试剂中含有碳酸钠,请设计实验检验该样品中仍含有氢氧化钠_______。
(5)将50g稀盐酸加入50g氢氧化钠溶液中恰好完全反应,所得溶液中溶质的质量分数为5.85%。试计算氢氧化钠溶液中溶质的质量分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com