
【题目】兴趣小组的同学对铝的某些性质进行相关探究。
(实验回顾)
(l)铝与稀盐酸反应。
①用图1所示装置制取氢气。

铝与稀盐酸反应的化学方程式为__________。
②用B装置收集氢气的原因是____________。
(2)在金属活动性顺序里,金属能否置换出盐酸和稀硫酸中的氢,判断的依据是__________。
(提出问题)
铝能否与水反应生成氢气?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(I)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。如生活中可用铝壶烧水。铝与氧气反应的化学方程式为_____________。
(2)除去铝表面氧化铝薄膜的方法(举一例)_________。除上述方法外,还可以将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
(实验探究)
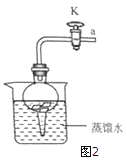
(1)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图2),其表面生成大量气泡、周围出现白色沉淀。铝与氯化汞溶液发生置换反应的化学方程式为__________。
(2)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)
铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式____________。
(实验反思)
(1)图2装置内,在铝与水反应的过程中,若关闭导管上的活塞K,反应停止,其原理是_______。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是________。
(2)汞有毒,会污染环境,兴趣小组的同学用硫粉处理单质汞,用饱和硫化钠溶液处理使用过的氯化汞废液。
【答案】2Al+6HCl==2AlCl3+3H2↑ 氢气难溶于水,不与水反应。 金属是否位于氢前面。 4Al+3O2==2Al2O3 用砂纸打磨 2Al+3HgCl2==2AlCl3+3Hg 上升 2Al+6H2O=2Al(OH)3+3H2 ↑ 关闭活塞K,容器内压强增大,把液体压回烧杯,固体与液体分离,反应停止。 容器内充满氢气,铝无法与氧气接触。
【解析】
【实验回顾】(l)铝与稀盐酸反应。①铝与稀盐酸反应的化学方程式为2Al+6HCl==2AlCl3+3H2↑。②用B装置收集氢气的原因是氢气难溶于水,不与水反应。(2)在金属活动性顺序里,金属能否置换出盐酸和稀硫酸中的氢,判断的依据是金属是否位于氢前面。【提出问题】铝能否与水反应生成氢气?【交流与讨论】(1)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。铝与氧气反应的化学方程式为4Al+3O2==2A12O3。(2)除去铝表面氧化铝薄膜的方法是用砂纸打磨。还可以将铝片浸入氯化汞( HgCI2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。【实验探究】(1) 将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,其表面生成大量气泡、周围出现白色沉淀。铝与氯化汞溶液发生置换反应的化学方程式为2Al+3HgCl2==2AlCl3+3Hg,铝比汞活泼。(2)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡上升,用燃着的木条点燃气泡,发出爆鸣声,这是我们检验氢气常用的方法。【实验结论】铝能与水反应生成氢气。铝与水反应生成氢氧化铝和氢气的化学方程式是2Al+6H2O=2Al(OH)3+3H2↑。【实验反思】(1)图2装置内,在铝与水反应的过程中,若关闭导管上的活塞K,反应停止,其原理是关闭活塞K,容器内压强增大,把液体压回烧杯,固体与液体分离,反应停止。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是容器内充满氢气,铝无法与氧气接触。
点睛∶金属活动顺序表的应用⑴排在氢前面的金属可以与稀硫酸或盐酸反应置换出氢气,排在氢后面的金属则不能⑵排在前面金属可以把排在其后面的金属从它的盐溶液中置换出来⑶从左到右金属活动性越来越弱。


科目:初中化学 来源: 题型:
【题目】Ⅰ.请结合下图回答问题。
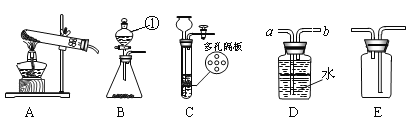
(1)写出图中有标号仪器的名称: ①__________________。
(2)用高锰酸钾制取一瓶干燥的氧气,可选用装置组合为___________(选填序号);实验室制取二氧化碳和氧气可选用发生装置C或B,C装置的优点是__________________,用此装置制取O2的化学方程式是____________________;
(3)实验室常用甲酸(HCOOH)溶液滴加到浓硫酸中制CO气体,可选用的制取装置是______(选填序号)。该反应中浓硫酸既是催化剂又是脱水剂,试写出该反应的化学方程式________________。
Ⅱ.某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
(查阅资料)
(1).CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
(2).Cu(OH) 2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
(猜想)蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③_______。猜想①的理由是:________(用化学方程式表示)。
(验证)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想 ________不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图_____(选填“甲”或“乙”)装置(装置中药品足量)。

(实验数据) ①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
③浓硫酸装置中数据如表。
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
(得出结论)猜想③成立,且碱式氯化铜中X∶Y:Z = _________。
(拓展延伸)
为使实验中生成蓝色固体,少出现蓝绿色固体,应作_______________改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】可燃冰是一种新型能源,在我国南海储量很高,其主要成分为甲烷(CH4)
(1)纯净的 CH4 气体在空气中燃烧的化学反应方程式为_____
(2)CH4 能还原 CuO,某化学兴趣小组同学设计实验探究 CH4 还原 CuO 的反应。
(提出问题)CH4 还原 CuO 的反应产物是什么?
(查阅资料)白色的无水硫酸铜固体遇水变蓝色。
(实验探究)

①在点燃 B 处酒精灯之前先通入甲烷气体的作用_____
②点燃酒精灯一段时间后 B 装置内的现象_________,证明有铜 生成;
③反应过程中,C 装置中的现象_________,证明有水生成;
④D 装置内澄清石灰水变浑浊,证明有_________生成;
⑤请根据以上信息写出 CH4 还原 CuO 的化学反应方程_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁是一种用途很广的金属,目前世界上 60%的镁是从海水中提取出来的.其重要步骤如下:

(1)上述步骤中试剂①应过量,理由是什么?_________________
(2)写出 Mg(OH)2沉淀与试剂②发生反应的化学方程式_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。

下列说法正确的是
A. 在a、b、c三种曲线所示的实验中,所用盐酸浓度越大,V时所得溶液的pH越大
B. 在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色
C. 在a、b、c三种曲线所示的实验中,反应速率相同
D. 在a、b、c三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:
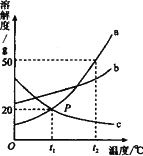
(1)t1℃时,a、b、c三种物质的溶解度由大小关系是_____________;
(2)t2 ℃时,将30g的a物质加入到50g水中,充分溶解后所得溶液的质量___g
(3)当a中含有少量b时,提纯a的方法是_________________ ;
(4)将相同质量的a、b、c的饱和溶液,从t2 ℃降温到t1℃,所得溶液质量由大到小的顺序是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究稀硫酸的化学性质,某化学兴趣小组的同学做了如下图所示实验,观察到试管①中的液体呈蓝色,试管②中有气泡冒出。实验结束后,将试管①、②内的物质全部倒入同一烧杯中,充分反应后静置,结果如图乙所示。有关图乙烧杯内混合物中的固体和溶液,下列说法正确的是
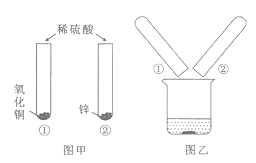
A. 固体中最多有两种物质
B. 若固体中有锌,则溶液中的溶质可能有两种
C. 若溶液呈酸性,则溶液中一定含有硫酸铜
D. 若溶液呈蓝色,则固体中可能有两种物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓元素的单质是半导体材料,其原子结构示意图及在元素周期表中的信息如图,从图中获得的信息错误的是
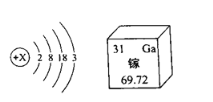
A. X=31
B. 镓属于非金属元素
C. 镓的相对原子质量是69.72
D. 镓原子核外有4个电子层
查看答案和解析>>
科目:初中化学 来源: 题型:
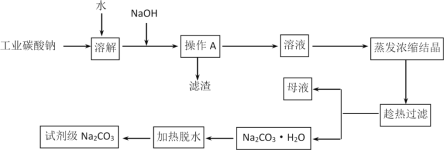
【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
碳酸钠的饱和溶液在不同温度下析出的溶质如下表所示:
温度(℃) | ﹤32 | 32~36 | ﹥36 |
析出物的化学式 | Na2CO3·10H2O | Na2CO3·7H2O | Na2CO3·H2O |
回答下列问题:
(1)操作A为过滤,所需的玻璃仪器有烧杯、玻璃棒和_____________,滤渣的主要成分为Fe(OH)3、Mg(OH)2和___________。
(2)“趁热过滤”的原因是____________________。
(3)“母液”中除了含有 Na+、CO32-、Cl-、OH-离子外,还含有________等离子(写出一个即可)。
(4)写出Na2CO3·H2O转化为Na2CO3的化学方程式_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com