
【题目】Ⅰ.请结合下图回答问题。
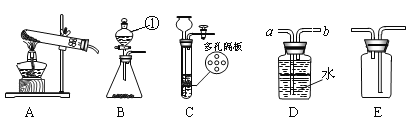
(1)写出图中有标号仪器的名称: ①__________________。
(2)用高锰酸钾制取一瓶干燥的氧气,可选用装置组合为___________(选填序号);实验室制取二氧化碳和氧气可选用发生装置C或B,C装置的优点是__________________,用此装置制取O2的化学方程式是____________________;
(3)实验室常用甲酸(HCOOH)溶液滴加到浓硫酸中制CO气体,可选用的制取装置是______(选填序号)。该反应中浓硫酸既是催化剂又是脱水剂,试写出该反应的化学方程式________________。
Ⅱ.某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
(查阅资料)
(1).CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
(2).Cu(OH) 2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
(猜想)蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③_______。猜想①的理由是:________(用化学方程式表示)。
(验证)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想 ________不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图_____(选填“甲”或“乙”)装置(装置中药品足量)。

(实验数据) ①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
③浓硫酸装置中数据如表。
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
(得出结论)猜想③成立,且碱式氯化铜中X∶Y:Z = _________。
(拓展延伸)
为使实验中生成蓝色固体,少出现蓝绿色固体,应作_______________改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行
【答案】 分液漏斗 AE 能控制反应的发生和停止(或随开随用,随关随停) 2H2O2 ![]() 2H2O+O2↑ BD HCOOH
2H2O+O2↑ BD HCOOH ![]() H2O+CO↑ Cux(OH)yClz与Cu(OH)2的混合物 CuCl2 +2NaOH=Cu(OH)2 ↓+2 NaCl ② 甲 X︰Y:Z= 2︰3:1 a b(少写、多写、错写不给分)
H2O+CO↑ Cux(OH)yClz与Cu(OH)2的混合物 CuCl2 +2NaOH=Cu(OH)2 ↓+2 NaCl ② 甲 X︰Y:Z= 2︰3:1 a b(少写、多写、错写不给分)
【解析】Ⅰ.(1)仪器①是分液漏斗;
(2)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,要收集干燥的氧气,需要用向上排空气法收集,可选用的装置组合为AE;C装置的优点是可以通过控制活塞的开关,来控制装置中的压强,使固体和液体分离与接触,从而控制反应的发生和停止;适合于装置C或B制氧气的是过氧化氢在二氧化锰的催化下生成水和氧气,化学方程式为:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(3)用甲酸溶液滴加到浓硫酸中制CO气体,通过分液漏斗可以向锥形瓶中滴加浓硫酸,因此选用的发生装置是B;由于一氧化碳有毒不用排空气法,所以用D装置收集,甲酸(HCOOH)溶液在浓硫酸作用下生成水和CO气体,化学方程式为:HCOOH ![]() H2O+CO↑;
H2O+CO↑;
Ⅱ. 【猜测】蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③Cu(OH)2、Cux(OH)yClz;猜想①的理由是:氯化铜和氢氧化钠反应生成蓝色沉淀氢氧化铜和氯化钠,反应的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
【实验】该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体,说明固体中含有氢氧化铜,则猜想②不正确;继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图甲装置,先通过浓硫酸时,通过质量变化可以检验是否生成水,后通过硝酸银时,然后产生白色沉淀,说明生成了氯化氢气体;
【延伸】(1)解:氢氧化铜受热分解得到的氧化铜质量为w
Cu(OH)2![]() CuO+ H2O
CuO+ H2O
80 18
w 251.80g-250.00g
![]()
w=8.00g
则碱式氯化铜分解所得氧化铜质量为24.00g-8.00g=16.00g,所以铜元素的质量为16.00g×![]() ×100%=12.80g
×100%=12.80g
设与硝酸银反应的氯化氢质量为n
HCl+AgNO3 =AgCl↓+HNO3
36.5 143.5
n 14.35g
![]()
n=3.65g,
所以碱式氯化铜中氯元素的质量为3.65g×![]() ×100%=3.55g
×100%=3.55g
则碱式氯化铜分解所得水的质量为253.60g-251.80g=1.80g,所以碱式氯化铜中氧元素的质量为1.80g×![]() ×100%+(16.00g-12.80g)=4.80g
×100%+(16.00g-12.80g)=4.80g
所以碱式氯化铜中X∶Y:Z =![]() =2︰3:1;
=2︰3:1;
(2)为使实验中生成蓝色固体,少出现蓝绿色固体,实验中可以将氯化铜溶液滴加到氢氧化钠溶液中,这样可以保证氢氧化钠足量;实验中应提供足量、较浓的氢氧化钠溶液,这样可以保证氢氧化钠足量。


科目:初中化学 来源: 题型:
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
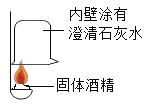
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图所示实验,回答问题。

(1)实验A中观察到的现象是____________________________________,说明CO2的密度比空气大,且______________________________。
(2)实验B中,铜片上的白磷燃烧而红磷不燃烧,由此证明燃烧所需要的条件是______________________________。
(3)实验C中红磷要过量,其目的是______________________,红磷燃烧的化学方程式是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是初中化学的一些基本实验,请根据实验内容回答下列问题.

(1)A实验结束待集气瓶冷却后,进入集气瓶中水的体积小于集气瓶容积的,可能的原因是 (填一条即可)。
(2)放置一周后,B实验观察到的现象是 。
(3)C实验产生氧气与氢气的体积比约为 。
(4)D实验观察到的现象是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
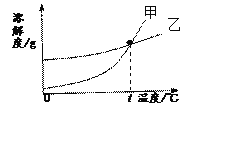
A. t℃在60℃到80℃之间,且甲表示KNO3的溶解度曲线
B. t℃时,甲、乙两种溶液的溶质质量分数不一定相等
C. 把60℃时的105g KNO3饱和液降温至20℃,能析出晶体78.4g
D. 两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用甲和乙两种物质在一定条件下反应生成丙和X,反应的微观示意图如图。参加反应的甲和乙及生成丙的质量比为甲:乙:丙=23:17:1.下列判断错误的是
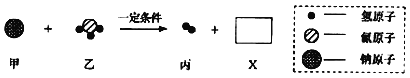
A. 丙属于单质
B. 参加反应的乙与生成丙的分子个数之比为1:1
C. 物质X中含三种元素
D. 甲这种物质是由原子直接构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年5月1l日,人民日报报道:中国科技大学曾杰教授研究团队发现新型催化剂,把CO2与H2高效转化为清洁液体燃料甲醇,实现了“人工碳循环”。如图为某科研小组设计的利用化学链燃烧产生的高浓度CO2制备甲醇的流程图,据图回答:
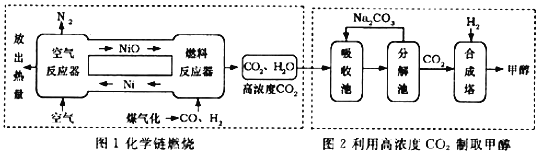
(1)图1是利用镍(Ni)进行化学链燃烧的流程图。与传统的燃料燃烧方式相比,化学链燃烧排放的CO2浓度高,易于收集。
①空气反应器中,金属镍与氧气在一定条件下燃烧生成氧化镍(NiO);燃料反应器中发生的部分化学反应如下:Ⅰ.H2+NiO![]() Ni+H2O;Ⅱ.CO+NiO
Ni+H2O;Ⅱ.CO+NiO![]() Ni+CO2,其中属于置换反应的是_____(填“Ⅰ”或“Ⅱ”),反应Ⅱ中发生还原反应的物质是_____。
Ni+CO2,其中属于置换反应的是_____(填“Ⅰ”或“Ⅱ”),反应Ⅱ中发生还原反应的物质是_____。
②与CO、H2直接在空气中燃烧相比,化学链燃烧排放出的CO2浓度更高的原因是_____。
(2)图2是利用高浓度CO2制取甲醇的流程图:吸收池内,饱和碳酸钠溶液吸收高浓度CO2生成碳酸氢钠;分解池内,碳酸氢钠受热分解放出CO2;合成塔内,利用新型催化剂,CO2与H2反应生成甲醇(CH4O)与水。
①吸收池内生成碳酸氢钠的化学方程式是_____。
②合成塔内生成甲醇的化学反应中,参加反应的H2与CO2的质量比是_____。该反应中,原料H2的理想来源是_____。如果将来H2的制取技术取得突破,“CO2与H2反应高效变甲醇”这一世界领先的研究成果的意义是_____(答出一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】重庆一中化学兴趣小组的同学们在实验室进行粗盐提纯实验,并用所得精盐配置50g溶质质量分数为5%的NaCl溶液。
(1)粗盐提纯实验的操作顺序为__________(填图中字母),称量精盐并计算产率;A操作中玻璃棒作用为______________________________。
(2)关于粗盐提纯实验下列说法正确的是_________(填序号)
①将粗盐直接放在天平左盘上进行称量 ②将蒸发皿放在石棉网上加热
③蒸发时待水分全部蒸干后停止加热 ④过滤后滤液仍浑浊应重新过滤
(3)配置NaCl溶液时,称量精盐发现天平指针偏左,应______(填序号)
A.增加适量砝码 B.减少适量砝码 C.增加适量精盐 D.减少适量精盐
(4)配置NaCl溶液溶质质量分数偏小,其原因可能有_______(填序号)
①粗盐溶解时不充分 ②过滤时滤纸破损
③蒸发时溶液飞溅 ④配溶液时称量的精盐仍潮湿
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学对铝的某些性质进行相关探究。
(实验回顾)
(l)铝与稀盐酸反应。
①用图1所示装置制取氢气。

铝与稀盐酸反应的化学方程式为__________。
②用B装置收集氢气的原因是____________。
(2)在金属活动性顺序里,金属能否置换出盐酸和稀硫酸中的氢,判断的依据是__________。
(提出问题)
铝能否与水反应生成氢气?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(I)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。如生活中可用铝壶烧水。铝与氧气反应的化学方程式为_____________。
(2)除去铝表面氧化铝薄膜的方法(举一例)_________。除上述方法外,还可以将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
(实验探究)
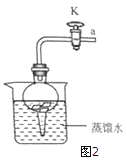
(1)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图2),其表面生成大量气泡、周围出现白色沉淀。铝与氯化汞溶液发生置换反应的化学方程式为__________。
(2)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)
铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式____________。
(实验反思)
(1)图2装置内,在铝与水反应的过程中,若关闭导管上的活塞K,反应停止,其原理是_______。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是________。
(2)汞有毒,会污染环境,兴趣小组的同学用硫粉处理单质汞,用饱和硫化钠溶液处理使用过的氯化汞废液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com