
| A. | 1或2 | B. | 2或3 | C. | 0或3 | D. | 0或1 |
分析 根据在化合物中正负化合价代数和为零,结合Nan+1RO2n+2的化学式进行解答即可.
解答 解:钠元素显+1价,氧元素显-2价,设R元素的化合价为x.
若n=0价,则(+1)×1+x+(-2)×2=0,x=+3价,有可能.
若n=+1价,则(+1)×2+x+(-2)×4=0,x=+6价,有可能.
若n=+2价,则(+1)×3+x+(-2)×6=0,x=+9价,超过了+7价,不可能.
若n=+3价,则(+1)×4+x+(-2)×8=0,x=+12价,超过了+7价,不可能.
故n值可能是0或1.
故选:D.
点评 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)并能灵活运用是正确解答本题的关键.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③⑤ | C. | ②⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末; ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 绝大部分黑色粉末被吸引 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 脱氧剂的成分是铁粉 红色物质是Fe203 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝和硫酸铜溶液 | B. | 氯化钠溶液和稀硫酸 | ||
| C. | 把二氧化碳通入澄清的石灰水 | D. | 碳酸钙固体和稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
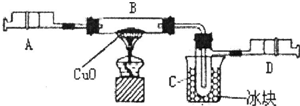
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
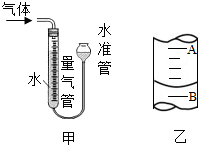
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | ∕ | |
| 2 | 2.0 | CuO 0.5 | |
| 3 | 2.0 | MnO2 0.5 |
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 将加热后残留的固体溶于足量的水,过滤后称重CuO的质量 | CuO的质量在反应前后是否保持不变 |
| 将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解 | CuO的化学性质在反应前后是否保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com