
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末; ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 绝大部分黑色粉末被吸引 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 脱氧剂的成分是铁粉 红色物质是Fe203 |
分析 (1)铜粉在常温下不能与氧气发生反应,铜转化为氧化铜需要在加热条件下才能实现;而铁粉在潮湿的空气中生锈而变成红色的氧化铁,常温下可以发生反应;活性炭能吸附有毒有味的气体但不能吸附氧气,氧化铁亦不能与氧气发生反应;据此,可对三个同学的猜想进行评价;
(2)利用猜想中所涉及物质的性质与变化规律,设计实验验证三位同学的猜想,并验证实验的实验报告.
(3)根据实验方案中的反应,依据质量守恒定律书写相关的化学方程式.
解答 解:(1)甲同学的猜想所认为的两种物质在常温下不能实现转化,所以,不适合用于食品的“脱氧剂”,猜想不合理;乙同学既考虑到铁与氧化铁两物质的颜色,又结合的两物质铁常温下可生锈变成氧化铁的转化关系,猜想合理;丙同学猜想中的活性炭不能吸附氧气、氧化铁也不能与氧气发生反应,猜想不合理;
故答案为:(1)乙,因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈.
(2)根据两种物质铁和氧化铁的性质,可取少量粉末用磁铁吸引,黑色粉末全部被吸起,说明黑色粉末为铁粉;把剩余的红色粉末放入稀硫酸中,红色粉末全部溶解,溶液变红黄色,可进一步用氢氧化钠验证,氢氧化铁是红褐色沉淀,可证明红色粉末为氧化铁;
故答案为:
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末 | 绝大部分黑色粉末被吸引 | 脱氧剂的成分是铁粉 |
| ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 红色物质是Fe203 |
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末 | 绝大部分黑色粉末被吸引 | 脱氧剂的成分是铁粉 |
| ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 红色物质是Fe203 |
点评 对猜想进行评价时,要结合物质所处的实际环境及在该环境下猜想中所涉及的反应能否发生,这样所做的猜想才是合理的.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
| 比较项目 | 实验操作 | 实验现象 | 得出结论 |
| 二氧化碳的含量 | 将澄清石灰水分别滴入盛有凌晨的空气和日照后的空气的集气瓶中 | 凌晨的空气变浑浊,日照后的空气中现象不明显 | 凌晨的空气中二氧化碳的含量比日照后的空气中更 高 |
| 氧气的含量 | 将燃着的木条分别伸入盛有凌晨的空气和日照后的空气你的集气瓶中 | 凌晨的空气中的木条很快熄灭,日照后的空气中的木条能燃烧一会再熄灭 | 凌晨的空气中氧气的含量比日照后的空气中更低 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 性质 | 用途 |
| A | 一氧化碳 | 还原性 | 冶炼金属 |
| B | 氧气 | 助燃性 | 医疗急救 |
| C | 氮气 | 稳定性 | 食品防腐 |
| D | 干冰 | 升华时吸收热量 | 制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
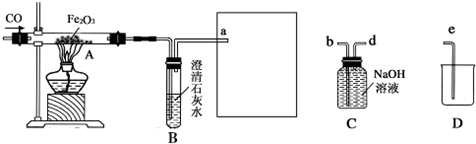
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
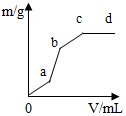 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )| A. | a-b产生的沉淀为硫酸钡 | |
| B. | a-b产生的沉淀为氢氧化镁 | |
| C. | b-c产生的沉淀为硫酸钡和氢氧化镁 | |
| D. | b-c产生的沉淀为氢氧化镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com