

分析 (1)根据二氧化硅的元素组成、酸碱盐、氧化物、有机物的特征确定所属类别.
(2)常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,写出反应的化学方程式即可.
(3)①根据制备粗硅的反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,确定反应类型.
②由生产高纯硅的流程示意图可知,盐酸既是反应物,又是生成物.
解答 解:(1)二氧化硅是分子构成的;是由硅、氧两种元素组成的且有一种是氧元素的化合物,属于氧化物.
(2)常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O.
(3)①制备粗硅的反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,该反应符合一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应.
②由生产高纯硅的流程示意图可知,为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是HCl.
故答案为:(1)分子;氧化物;(2)2NaOH+SiO2=Na2SiO3+H2O;(3)①置换;②HCl.
点评 本题难度不大,但综合性较强,考查了同学们新信息获取、处理及灵活运用所学知识进行分析问题、解决问题的能力.


科目:初中化学 来源: 题型:解答题
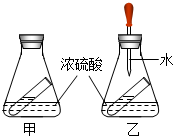 如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.
如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 224mL H2(标准状况)和0.5molN2 | B. | 5.6L N2(标准状况)和5.6g CO2 | ||
| C. | 11.2L H2O(标准状况)和0.5molBr2 | D. | 10g N2和10g CO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
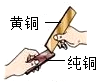 合金是重要的金属材料.
合金是重要的金属材料.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 实验操作 | 实验现象 | 结论与解释 |
| 试管1 | 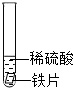 | 铁片表面产生气泡较慢, 溶液变为浅绿色 | (1)实验前用砂纸打磨金属片的目的是去除金属表面的污物和氧化物等. (2)甲同学得到的结论是猜想①正确 |
| 试管2 | 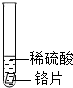 | 铬片表面产生气泡较快, 溶液变为蓝色 | |
| 试管3 | 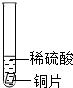 | 铜和稀硫酸不反应 |
| 实验 | 实验操作 | 实验现象 | 结论与解释 |
| 试管4 | 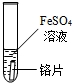 | 浅绿色的硫酸亚铁溶液变成蓝色,铬表面有红色物质生成 | (1)甲同学的结论正确 (2)请写出铬与硫酸铜反应的化学方程式Cr+CuSO4=CrSO4+Cu |
| 试管5 | 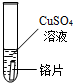 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
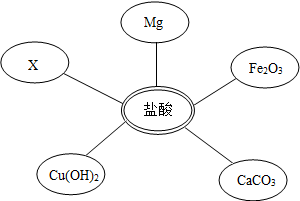
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |
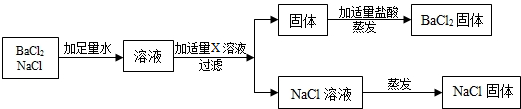
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 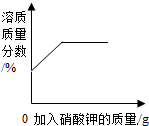 20℃时,向一定量的水中不断加入硝酸钾固体 | |
| B. | 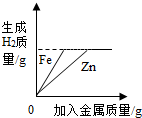 向等质量等质量分数的稀硫酸中分别加入足量等质量的锌和铁 | |
| C. | 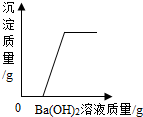 向盐酸和硫酸钠的混合溶液中逐滴加入氢氧化钡溶液 | |
| D. |  向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com