
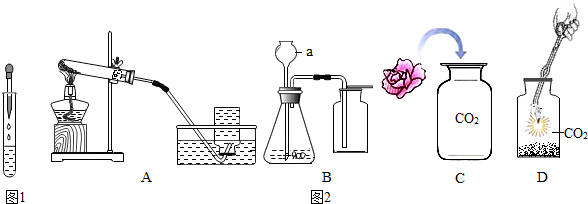
分析 【实验一】(1)根据酸石蕊遇到酸碱变色情况分析解答;
(2)据胶头滴管的使用方法进行分析;
(3)根据烧碱--氢氧化钠和盐酸反应原理书写化学方程式;
【实验二】(1)要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,据此书写方程式,反应属于固体加热型,故选装置A,加热高锰酸钾制取氧气时试管口要放一团棉花,防止高锰酸钾粉末进入导管;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
(4)二氧化碳和水反应能生成碳酸,碳酸能使石蕊试液变红色.
解答 解:【实验一】(1)石蕊溶液遇酸变红,在中性溶液中显紫色,紫色石蕊溶液,振荡后发现液体变红,说明污水显酸性,然后慢慢滴入烧碱--氢氧化钠溶液,边滴边振荡,直至溶液恰好变为紫 色,证明它们恰好完全反应;
(2)胶头滴管使用时要垂直悬空,由图示可知,这个同学在做实验时,将滴管伸入了试管内;
(3)NaOH溶液与稀盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl=NaCl+H2O;
【实验二】(1)仪器a的名称是长颈漏斗,通过长颈漏斗可以向反应容器中注入液体药品;
(2)实验室用高锰酸钾固体制取氧气需要加热,属于固体加热型,氧气不易溶于水,所以选择A装置制取氧气,高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;实验时发现水槽中的水变红可能原因是试管口未放棉花,加热时高锰酸钾粉末进入水槽;
(3)实验室用大理石和稀盐酸制取二氧化碳不需要加热,属于固液常温型,应选用的装置是B,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,收集一瓶二氧化碳时,将燃着的木条放在集气瓶口,若观察到燃着的木条熄灭,说明瓶中已充满二氧化碳;
(4)可观察到的实验现象是小花干燥的一半无变化,湿润的一半变为红色,此反应的化学方程式为:H2O+CO2═H2CO3.由此说明二氧化碳可与水反应生成酸;
故答案为:
【实验一】(1)酸;紫;(2)胶头滴管伸入试管内;(3)NaOH+HCl=NaCl+H2O;
【实验二】(1)长颈漏斗;
(2)A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;试管口未放棉花;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑、燃着的木条熄灭;
(4)小花干燥的一半无变化,湿润的一半变为红色;H2O+CO2═H2CO3;二氧化碳可与水反应生成酸.
点评 本题考查了酸碱中和反应、装置选取、物质的性质等知识,实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
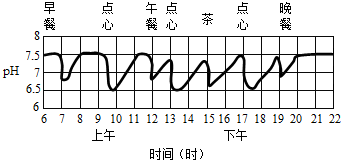
| A. | 酸性 | B. | 碱性 | ||
| C. | 中性 | D. | 有时酸性,有时碱性 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
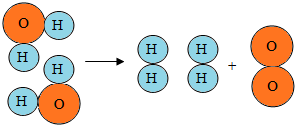 如图,从水分子分解示意图中获得以下信息,其中说法正确的是A
如图,从水分子分解示意图中获得以下信息,其中说法正确的是A查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com