
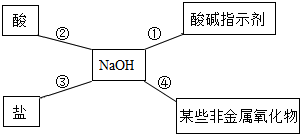

分析 (1)根据用pH测定酸碱度的方法、酸碱中和反应、铵态氮肥遇碱性物质会产生氨气来分析;
(2)Ⅰ.根据紫色石蕊试液遇碱变成蓝色分析;
Ⅱ.根据复分解反应的条件:必须有水、沉淀或气体生成;
(3)Ⅰ.氢氧化钾能够吸收空气中的二氧化碳,并且能够反应生成碳酸钾和水;
Ⅱ.碳酸钾能和稀盐酸反应生成氯化钠、水和二氧化碳;
Ⅲ.①过滤可以把不溶于水的物质除去;
②氯化钙和碳酸钾反应能生成碳酸钙沉淀和氯化钾;
(4)碳酸钠能和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠分析.
解答 解:(1)测得该土壤的酸碱度的方法是:取土壤样品少量于烧杯中,加入适量水,搅拌,静置,用玻璃棒蘸取土壤溶液滴到pH试纸,将试纸显示的颜色与标准比色卡比较,即测得该溶液的pH.
改良此土壤的酸性,一般加入熟石灰,故填:Ca(OH)2;
铵态氮肥遇碱性物质会产生氨气,会降低肥效,故刚施用了化肥硝酸铵,若想改良此土壤的酸性,不能立即加入氢氧化钙;反应的化学方程式:Ca(OH)2+2 NH4NO3=Ca(NO3)2+2H2O+2 NH3↑;
(2)Ⅰ.紫色石蕊试液遇碱变成蓝色,所以紫色石蕊试液滴入NaOH溶液中,溶液由无色变成蓝色,故填:蓝色;
Ⅱ.氢氧化钠与盐反应属于复分解反应,复分解反应的条件:必须有水、沉淀或气体生成.
a.Na2CO3和氢氧化钠不反应,故错误;
b.HCl是酸,不符合题意,故错误;
c.FeCl3和NaOH反应生成氢氧化铁沉淀,满足复分解反应的条件,故正确;
d.Ba(NO3)2和氢氧化钠不能满足复分解反应的条件,所以不反应,故错误;
反应的化学方程式:3NaOH+FeCl3═Fe(OH)3↓+3 NaCl;
(3)由假设二、三可知,假设一:只含KOH;
Ⅰ.成分中可能含有K2CO3的原因是:氢氧化钾和二氧化碳发生反应生成碳酸钾和水,化学方程式为:2KOH+CO2═K2CO3+H2O.
Ⅱ.取少量样品于试管中,加入足量稀盐酸,如果观察到有气泡产生,说明样品中含有碳酸钾,说明假设2或假设3成立.
Ⅲ.①操作1的名称是过滤,可以把反应生成的碳酸钙分离出来.由于碳酸钾和绿环该反应生成了碳酸钙沉淀和氢氧化钾,所以固体A是碳酸钙,碳酸钙的化学式是CaCO3.
②为了排除碳酸钾对实验结果的影响,应该加入足量CaCl2溶液把碳酸钾除去;
(4)要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的氢氧化钡溶液、氢氧化钙溶液,不能选择氯化钙溶液,因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,因此使用氯化钙时能够带入新杂质--氯化钠.
答案:
(1)取土壤样品少量于烧杯中,加入适量水,搅拌,静置,用玻璃棒蘸取土壤溶液滴到pH试纸,将试纸显示的颜色与标准比色卡比较,即测得该溶液的pH.
Ca(OH)2;不能; Ca(OH)2+2 NH4NO3=Ca(NO3)2+2H2O+2 NH3↑;
(2)Ⅰ蓝色;Ⅱc; 3NaOH+FeCl3═Fe(OH)3↓+3 NaCl;
(3)KOH;Ⅰ.2KOH+CO2═K2CO3+H2O;Ⅱ.产生气泡(或有气体生成);
Ⅲ.①CaCO3;②将碳酸钾完全反应,防止对接下来的实验干扰;
(4)A C;
Na2CO3+Ca(OH)2═CaCO3↓+2 NaOH 和 Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
点评 本题考查酸碱盐的性质及利用性质除去物质中混有的杂质,是常见习题,考查学生考虑问题的全面性,尤其注意在除杂时不要引入新的杂质.合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
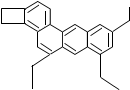
| A. | “小狗烯”属于氧化物 | |
| B. | “小狗烯”由碳、氢、氧三种元素组成 | |
| C. | “小狗烯”中碳元素的质量分数为92.3% | |
| D. | “小狗烯”中碳、氢元素的质量比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com