
����Ŀ���ҹ��Ŵ���¯��ʯ����Ҫ�ɷ֣�ZnCO3������ͭ����Ҫ�ɷ֣�Cu2O����ľ̿��Ϊԭ���Ƶû�ͭ��ͭ��п�ĺϽ�����ƻƽ𣩣�������������ͼ1��
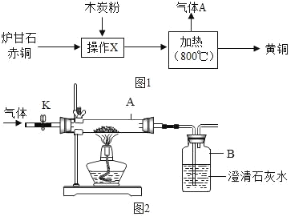
�ش��������⣺
��1����ͭ����Ҫ�ɷ�Cu2O��ͭԪ�صĻ��ϼ�Ϊ_____
��2������ʱ����������Ҫ��Ӧ��ѧ����ʽΪ����ZnCO3![]() ZnO+CO2������2ZnO+C
ZnO+CO2������2ZnO+C![]() 2Zn+CO2������_____����ͭ��ľ̿�۷�Ӧ��
2Zn+CO2������_____����ͭ��ľ̿�۷�Ӧ��
��3��ij��ȤС��ͬѧ��������Ӧ���ɵ�����A�ijɷֽ����о���
��������⣩���ɵ��������Ƿ���һ����̼��
��ȤС��ͬѧ����ͼ2��ʾ��װ�ý���ʵ�飬�����ɵ�����ɷֽ���̽����
��ʵ�������ۣ�
����K������ͨ�����ĵ���һ��ʱ�䣮
���ر�K��������һ���¶�ʹ�������е�¯��ʯ����ͭ��ľ̿�۷�Ӧ���������ռ�������Ʒ��
������ȥ������Ʒ�еĶ�����̼������ʣ�������ռ��ڼ���ƿ�У�����ͼ3װ������Ϊ��������_____��
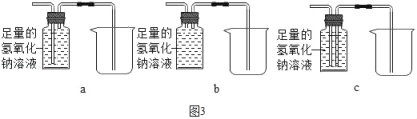
��ʵ����֤��������������̼���������Ʒ�����Ȼ��ͼ2��ʾ��װ�ý���ʵ�飬A�еĹ���Ӧѡ��_____��B����ҺΪ����ʯ��ˮ����A�к�ɫ��������˺�ɫ��B�г���ʯ��ˮ_____���仯ѧ����ʽΪ_____����˵��������Ʒ�к���һ����̼��
��ʵ�鷴˼������ʵ���У������ɵ������к���һ����̼����Ӧʱ����̼����Ԫ�ص�������_____������ڡ��������ڡ���С�ڡ���3��8��
��4����һ��ȤС��ͬѧ��������Ӧ���ɵĹ���ɷֽ������о���
����ͬѧ˵��ͭ��п�Ͻ���ͬѧ˵�����ǽ�
������ͬѧ������ͬѧ�IJ²⣮��������_____��
��Ϊ�ⶨ�û�ͭ��ͭ��п�Ͻ���ͭ������������ij��ȤС��ȡ20g��ͭ��Ʒ����ʢ��200gϡ������ձ��У�ǡ����ȫ��Ӧ������ձ���ʣ�����ʵ�������Ϊ219.8g���û�ͭ��Ʒ��ͭ����������Ϊ_____��������������0.1%��
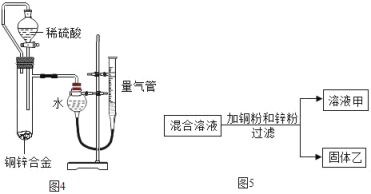
���е���ȤС����ͼ4װ�òⶨ��ͭ��ͭ���������������й��ڸ�ʵ���˵����ȷ����_____
A����Һ©�����Թܼ���ܽ���ʹҺ��˳���µε�����
B����ʵ����ϡ����㣬�����·�Һ©���Ϸ�����Ƥ������
C���òⶨ����Ҫ����������Ʒ�����ʹ��¶ȡ�ѹǿ���������ܶ�
D��ʵ�����ʱ������ȴ�����²��������ܻ�������������Һ����ƽ�ٶ���
��5����չ����
��ij��ѧС����һ����AgNO3��Al��NO3��3�Ļ����Һ����ͭ�ۺ�п�ۣ���ַ�Ӧ����ˣ��õ���Һ�����ң���ͼ5��ʾ����
a����Һ����һ������Al��NO3��3��Zn��NO3��2
b����������һ������Ag�����ܺ���Cu��Zn
c������Һ������ɫ������Һ��һ������Al��NO3��3��Zn��NO3��2��Cu��NO3��2
d����������ϵμ����������ݲ���������Һ����һ��û��AgNO3��Cu��NO3��2
��������˵����ȷ�ĸ���Ϊ_____
A��1�� B��2�� C��3�� D��4��
�����÷Ͼɵ��ͭñ����Cu��Zn����ȡCu�����õ�ZnSO4��Һ����Ҫ������ͼ6������֪���ٷ�Ӧ��������ȥ����2Cu+2H2SO4+O2![]() 2CuSO4+2H2O����
2CuSO4+2H2O����

a����ҺA����C������_____����Ԫ�أ����̢��еķ��������_____��
b����д��������з�����Ӧ�Ļ�ѧ����ʽ��_____��
���𰸡�+1 2Cu2O+C![]() 4Cu+CO2�� C ����ͭ ����� CO+CuO
4Cu+CO2�� C ����ͭ ����� CO+CuO![]() Cu+CO2 ���� ��ѧ��Ӧǰ��Ԫ�ص������ 67.5% CD D ͭ��п ���� Zn+H2SO4�TZnSO4+H2��
Cu+CO2 ���� ��ѧ��Ӧǰ��Ԫ�ص������ 67.5% CD D ͭ��п ���� Zn+H2SO4�TZnSO4+H2��
��������
���ݻ��ϼ۹���ѧ����ʽ����д����ȥ������̼ʹ������������Һ����ˮ���ռ�������ˮ�ӳ����ų��������غ㶨�ɻ�ѧ��Ӧǰ��Ԫ�ص�����䣻�ڽ������˳���У�λ����ǰ�Ľ����ܽ�λ�����Ľ�����������Һ���û������������Թ����Һ��ķ��뷽����ɡ�
��1����Cu2O��ͭԪ�صĻ��ϼ�Ϊx�����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ�㣬����2x+����2����0��x��+1�����+1
��2������ʱ��������ͭ��̼���·�Ӧ����ͭ�Ͷ�����̼�����2Cu2O+C![]() 4Cu+CO2��
4Cu+CO2��
��3��������ȥ������Ʒ�еĶ�����̼������Ҫͨ������������Һ��Ҫ��ʣ�������ռ��ڼ���ƿ�У�����Һ��Ҫ�ӳ����ų�����ͼ3װ������Ϊ�������� C�����C
[ʵ����֤]A�к�ɫ��������˺�ɫ��˵��A�еĹ���Ӧѡ�õ�������ͭ��һ����̼������ͭ��Ӧ����ͭ�Ͷ�����̼����B�г���ʯ��ˮ����ǣ��仯ѧ����ʽΪ CO+CuO![]() Cu+CO2���������ͭ������ǣ�CO+CuO
Cu+CO2���������ͭ������ǣ�CO+CuO![]() Cu+CO2
Cu+CO2
[ʵ�鷴˼]
һ����̼��̼����Ԫ��������Ϊ3��4��������̼��̼����Ԫ��������Ϊ3��8�������ɵ������к���һ����̼����Ӧʱ����̼����Ԫ�ص������ȴ���3��8���������
��4���ٸ��������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣬��ʯ�в����н�Ԫ�أ��ʲ��������ɽ𣬹����ѧ��Ӧǰ��Ԫ�ص������
��п��ϡ���ᷴӦ����������ͭ���ܣ���Ӧǰ�������Ϊ��������������������������������Ϊ��20g+200g��219.8g��0.2g
����Ʒ��п������Ϊx

![]() ��x��6.5g
��x��6.5g
�ʸû�ͭ��Ʒ��ͭ����������Ϊ��![]() �����67.5%
�����67.5%
����ͼ4װ�òⶨ��ͭ��ͭ����������ʱ��
A����Һ©�����Թܼ���ܳ���ʹҺ��˳���µε����ã��������ܷ�����ã�˵������
B����ʵ����ϡ����㣬�������·�Һ©���Ϸ�����Ƥ�����ӣ����������װ��©����˵������
C���òⶨ����Ҫ����������Ʒ�����ʹ��¶ȡ�ѹǿ���������ܶȣ�˵����ȷ��
D��ʵ�����ʱ������ȴ�����²��������ܻ�������������Һ����ƽ�ٶ�����˵����ȷ�����CD
��5����ij��ѧС����һ����AgNO3��Al(NO3)3�Ļ����Һ����ͭ�ۺ�п�ۣ�п��ͭ�������ĺ��棬��������������Ӧ��ֻ������������Ӧ��������п������������Ӧ��
a��п�Ȳ��뷴Ӧ������Һ����һ������Al(NO3)3��Zn(NO3)2��˵����ȷ��
b����������һ������Ag�����ܺ���Cu��Zn��˵����ȷ��
c������Һ������ɫ������Һ��һ������Al(NO3)3��Zn(NO3)2��Cu(NO3)2��˵����ȷ��
d����������ϵμ����������ݲ�������пʣ�࣬����Һ����һ��û��AgNO3��Cu(NO3)2��˵����ȷ��
��˵����ȷ�ĸ���Ϊ4�������D
��
a����ҺA������п������ͭ�����ܺ��й��������ᣬ�������B��п����Ӧ��п������ͭ��Ӧ�õ�ͭ�������C����ͭ������п����A��C�ж�����ͭ��п����Ԫ�أ������������з���õ����ǹ����Һ�壬�÷�������ǹ��ˣ��������
b���������п��ϡ���ᷴӦ��������п��������ͭ�������Ӧ��������Ӧ�Ļ�ѧ����ʽ��Zn+H2SO4�TZnSO4+H2�������Zn+H2SO4�TZnSO4+H2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ʵ������ֺͷ�����գ�������þ��þԪ����+2��___________����1����������___________�� �ۺ���_________�� ���γɻ�������������Ԫ��________��
��2�������������ʣ�ѡ����Ӧ���ʵ���ĸ��գ�A���ʯ B���� CС�մ� D��ʯ�� E������ F�̸�
��____����������θ�����֢ ��____����������ֹ�
��____�ǹ���ϸ���Ļ������� ��____�������и����ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ44.4�˺�������NaCl �Ĵ���壨Na2CO3nH2O����Ʒ��ƽ���ֳ�A��B��C���ݣ�������ͼʵ�飨Na2CO3���Ȳ��ֽ⣩��
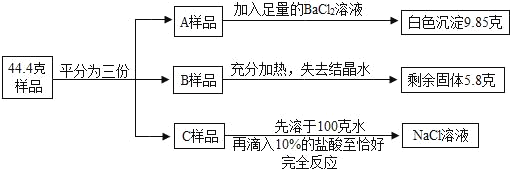
��1����A��Ʒ��BaCl2��Һ��Ӧ���ɵİ�ɫ������������ķ�����_____��
��2��A��Ʒ����BaCl2��Һ��Ӧ��Na2CO3��������_____�ˡ�
��3��B��Ʒ�к��нᾧˮ��������_____�ˡ�
��4����ѧʽNa2CO3nH2O��n��_____
��5����C��Ʒ�IJ�������������NaCl��Һ���������������Ƕ���_____������ȷ��0.01%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾͼ�����й����ı仯�������Ӧ������ϵ��ȷ���ǣ�������
A. 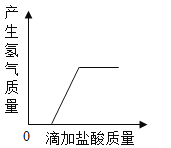 ��һ�������Ĵ�ĥ������пƬ�еμ�����
��һ�������Ĵ�ĥ������пƬ�еμ�����
B. 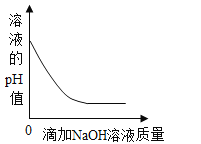 ��һ��������ϡ�����еμ�����������Һ
��һ��������ϡ�����еμ�����������Һ
C. 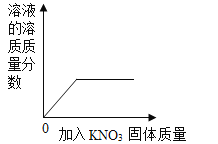 һ���¶�����һ����ˮ�м���KNO3����
һ���¶�����һ����ˮ�м���KNO3����
D. 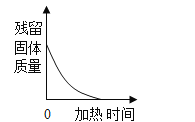 ����һ�������ĸ��������ȡ����
����һ�������ĸ��������ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A. 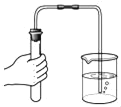 ����װ��������
����װ��������
B. 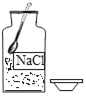 ȡ�����Ȼ���
ȡ�����Ȼ���
C. 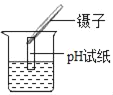 ����ҺpH
����ҺpH
D. 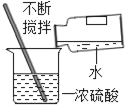 ϡ��Ũ����
ϡ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NSR ����ͨ�� BaO �� Ba(NO3)2 ���ת��ʵ�� NOx(��������)�Ĵ���ͻ�ԭ������Ч���Ͳ��ͷ������ڿ������������µ� NOx �ŷš��乤��ԭ����ͼ��ʾ������˵������ȷ����
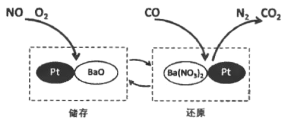
A. ���� NOx �ŷſ��Լ��ٿ�����������γ�
B. ����ʱ������ NOx (�� NO, NO2)�������� Pt
C. ��ԭʱ�������ķ�Ӧ��: ![]()
D. ���� 28 g CO ���뷴Ӧ�������� CO2 ������Ϊ 44g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���������ճ������о������������⣬��ˮ������ٻ�����ҪΪ���ۡ�ʳ�������ë���ȡ����ܵ�ͨ����ʹ�����Ĺܵ���ͨ���衣��ѧ��ȤС������ܵ�ͨ���е����ʽ�����̽��:

���������ϣ�
(1)����������ǿ���ȥ�����ۣ���ʴë��һ��Ķ�������������ͨ�ܵ���
(2)���۳�����ɫ��������ǿ�ᡢǿ����Һ����Ѹ�ٷ�Ӧ�ų�������ͬʱ�ų������ȡ�
���������ᷴӦ�Ļ�ѧ����ʽΪ_____��
����������������Һ��Ӧ�Ļ�ѧ����ʽΪ_____=2NaAlO2+3H2��
(1)����������֤����һ�����ܵ�ͨ��������һ����ɫ���������һ������ɫ��ĩ��
(1)����:��ɫ�������Ϊ�������ơ�
ʵ����� | ʵ������ |
�ٽ�������ɫ�������ڱ�������,¶���ڿ�����Ƭ�̡� | _____ |
�ڽ�������ɫ��������ʢ������ˮ���Թ���,�����ִ����Թ���ڡ� | �Թ�����¶����� |
������ڵõ�����Һ�з���һ����ë�ߣ�����һ��ʱ�䡣 | ��ë����С |
����:��ɫ�������Ϊ�������ơ�
(2)����:����ɫ��ĩΪ���ۡ�
ʵ����� | ʵ������ |
��ȡ�����÷�ĩ�ڽྻ���Թ��У��μ�ϡ���ᣬ���ִ��� �Թ���ڣ���ȼ��Ӧ���������� | �����������ݣ��Թ�����¶��������ߣ�����ȼ�ղ�������ɫ���档 |
��ȡ�����÷�ĩ�ڽྻ���Թ��У��μ�_____�����ִ��� �Թ���ڣ���ȼ��Ӧ���������� |
����:����ɫ��ĩΪ���ۡ�
��Ӧ�ã�
(2)ʹ�����ܵ�ͨ��ʱ���Ƚ�����ɫ��״���������뱻�����Ĺܵ��У��ټ����ɫ�������������һ��ˮ�����Ϲܵ��ڡ��ܵ��ڿ��ܳ��ֵ�������_____.(�����)
A.�ܵ����¶���������
B.������������
C.�ܵ�����ͨ
(3)���ܵ�ͨ���ڵ��������ʱ����ܷⱣ�棬����ᷢ�����ʡ��û�ѧ����ʽ��ʾ���е�ԭ��:_____��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס������ֹ������ʵ��ܽ�����ߡ�
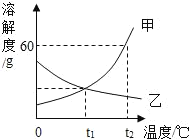
��1�����¶�Ϊ_____��ʱ���ס����������ʵ��ܽ����ȣ�
��2���ס����������У�ͨ�����µķ����ܽ��ӽ����͵���Һ��Ϊ������Һ����_____��
��3��t2��ʱ����8g������Ͷ�뵽10gˮ�У�����ܽ��õ�����Һ��������������Ϊ_____����ȷ��0.1%����
��4����һ���ķ��������ҵIJ�������Һ��Ϊ������Һ������˵����ȷ����_____��
a�ܼ����������ܲ���
b������������һ�����
c��Һ���������ܲ���
d���ʵ�����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С��ͬѧΪ�˲ⶨijNa2CO3��Һ�����ʵ�����������ȡ10g����Һ���ձ��У�Ȼ��400g����ʯ��ˮ���Ĵμ��룬�ձ��г�����������ÿ�μ������ʯ��ˮ��������ϵ���������㣺
��һ�� | �ڶ��� | ������ | ���Ĵ� | |
�������ʯ��ˮ������/g | 100 | 100 | 100 | 100 |
���ɳ���������/g | 0.4 | m | 1.0 | 1.0 |
��1������m��ֵΪ_____��
��2��Na2CO3��Һ�����ʵ���������_____��д��������̣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com