
【题目】下水道堵塞是日常生活中经常遇到的问题,下水管里的淤积物主要为油污、食物残渣、毛发等。“管道通”可使堵塞的管道畅通无阻。化学兴趣小组对“管道通”中的物质进行了探究:

(查阅资料)
(1)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(2)铝粉呈银白色。铝粉与强酸、强碱溶液都能迅速反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式为_____。
②铝与氢氧化钠溶液反应的化学方程式为_____=2NaAlO2+3H2↑
(1)(猜想与验证)打开一盒“管道通”,内有一袋白色固体颗粒和一袋银白色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在表面皿上,露置在空气中片刻。 | _____ |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | 试管外壁温度升高 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线缩小 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银白色粉末为铝粉。
实验操作 | 实验现象 |
①取少量该粉末于洁净的试管中,滴加稀盐酸,用手触摸 试管外壁,点燃反应产生的气体 | 产生大量气泡,试管外壁温度明显升高,气体燃烧产生淡蓝色火焰。 |
②取少量该粉末于洁净的试管中,滴加_____,用手触摸 试管外壁,点燃反应产生的气体 |
结论:银白色粉末为铝粉。
(应用)
(2)使用“管道通”时,先将银白色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是_____.(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
(3)“管道通”内的两种物质必须密封保存,否则会发生变质。用化学方程式表示其中的原因:_____、_____。
【答案】![]() 2Al+2NaOH+2H2O 固体表面潮解 氢氧化钠溶液 ABC
2Al+2NaOH+2H2O 固体表面潮解 氢氧化钠溶液 ABC ![]()
![]()
【解析】
查阅资料:
①铝与盐酸反应生成氯化铝和氢气,反应的化学方程式是:![]() ;
;
②根据“铝粉与强酸、强碱溶液都能迅速反应放出氢气”,结合化学方程式可知,铝与氢氧化钠溶液反应时的反应物铝、氢氧化钠和水,生成物是NaAlO2和H2,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。故填:2Al+2NaOH+2H2O;
猜想与验证:
(1)猜想:若白色固体颗粒为氢氧化钠,氢氧化钠在空气易吸收空气中的水而潮解。所以将几粒白色颗粒放在表面皿上,露置在空气中片刻,观察到的实验现象是;固体表面潮解;
(2)猜想:若银白色粉末为铝粉,铝既能够与酸反应,又能够与碱反应,所以向一只试管中滴加稀盐酸,另一只中滴加的应该是显碱性的溶液,氢氧化钠溶液显碱性。故填:氢氧化钠溶液;
应用:
氢氧化钠溶于水时放出大量的热,管道内温度明显升高;铝和氢氧化钠溶液反应时能够生成氢气,同时放出大量的热;由于反应生成气体且放出热量,管内气体的压强增大,管道被疏通。故选ABC;
(3)“管道通”内的铝在空气中易与氧气反应生成氧化铝,氢氧化钠在空气中易与二氧化碳反应生成碳酸钠和水,两种物质必须密封保存,反应的化学方程式分别为:![]() 、
、![]() 。
。


科目:初中化学 来源: 题型:
【题目】研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_________,检验B中气体的现象是___________。
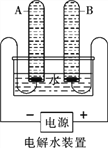
②微观该反应中发生分解的微粒名称是___________。
③结论:水由__________组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_________。
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
②下列实验中,对水的主要作用分析不全面的是_________(填字母)
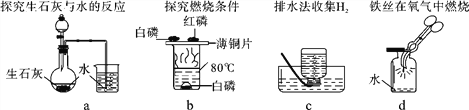
A.a图中的水便于观察烧瓶内气压变化
B.b图中的水提供热量
C.c图集气瓶中的水排尽空气且便于观察H2何时集满
D.d图中的水防止熔融物炸裂集气瓶
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
方案一: 取10g石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g
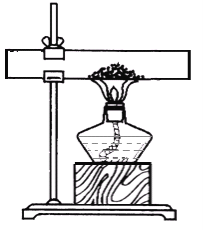
方案二:另取10g同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g
相关资料:
当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.
计算出两种方案测得的石灰石中碳酸钙的质量分数:
(1)方案一中碳酸钙的质量分数是 ;
(2)方案二中碳酸钙的质量分数是 .(精确到0.1%)
比较两方案测量的结果,分析两方案误差较大的可能原因?
查看答案和解析>>
科目:初中化学 来源: 题型:
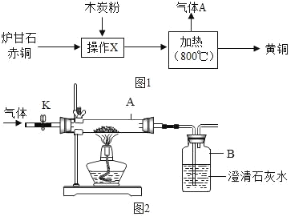
【题目】我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得黄铜(铜和锌的合金,外观似黄金),其生产流程如图1:
回答下列问题:
(1)赤铜中主要成分Cu2O的铜元素的化合价为_____
(2)加热时,发生的主要反应化学方程式为:①ZnCO3![]() ZnO+CO2↑;②2ZnO+C
ZnO+CO2↑;②2ZnO+C![]() 2Zn+CO2↑;③_____(赤铜和木炭粉反应)
2Zn+CO2↑;③_____(赤铜和木炭粉反应)
(3)某兴趣小组同学对上述反应生成的气体A的成分进行研究.
(提出问题)生成的气体中是否含有一氧化碳?
兴趣小组同学利用图2所示的装置进行实验,对生成的气体成分进行探究.
(实验与讨论)
①打开K,缓缓通入干燥的氮气一段时间.
②关闭K,加热至一定温度使玻璃管中的炉甘石、赤铜和木炭粉反应,用气囊收集气体样品.
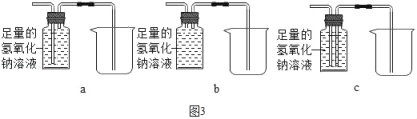
③欲除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图3装置中最为合理的是_____.
(实验求证)将除尽二氧化碳后的气体样品干燥,仍然用图2所示的装置进行实验,A中的固体应选用_____,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水_____,其化学方程式为_____,可说明气体样品中含有一氧化碳.
(实验反思)上述实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比_____(填“大于”、“等于”或“小于”)3:8.
(4)另一兴趣小组同学对上述反应生成的固体成分进行了研究.
①甲同学说是铜、锌合金.乙同学说可能是金.
其他的同学否定了乙同学的猜测.其理由是_____.
②为测定该黄铜(铜、锌合金)中铜的质量分数,某兴趣小组取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的总质量为219.8g,则:该黄铜样品中铜的质量分数为_____.(计算结果保留0.1%)
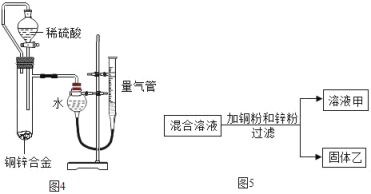
③有的兴趣小组用图4装置测定黄铜中铜的质量分数.下列关于该实验的说法正确的是_____
A.分液漏斗与试管间的橡胶管仅有使液体顺利下滴的作用
B.若实验中稀硫酸不足,可以拔下分液漏斗上方的橡皮塞添加
C.该测定还需要的数据是样品质量和此温度、压强下氢气的密度
D.实验结束时,需冷却至室温并将量气管缓缓下移至两侧液面相平再读数
(5)拓展延伸
①某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图5所示,则:
a.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
b.固体乙中一定含有Ag,可能含有Cu和Zn
c.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
d.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为_____
A.1个 B.2个 C.3个 D.4个
②利用废旧电池铜帽(含Cu、Zn)提取Cu,并得到ZnSO4溶液,主要流程如图6,(已知:①反应条件已略去;②2Cu+2H2SO4+O2![]() 2CuSO4+2H2O).
2CuSO4+2H2O).

a.溶液A和固体C都含有_____两种元素,过程Ⅱ、Ⅲ中的分离操作是_____.
b.请写出步骤Ⅲ中发生反应的化学方程式:_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列变化的化学方程式,并按要求填空。
(1)红磷在空气中燃烧:_____,红磷燃烧时放出大量热,产生大量_____。
(2)稀盐酸除去铁锈:_____,溶液由无色变为_____。
(3)葡萄糖在动物体内酶的催化下缓慢氧化:_____,反应时_____(填“放出”或“吸收”)热量。
(4)硫酸铵与熟石灰混合研磨:_____,反应仪器是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氧气 |
解释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔融物,防止集气瓶炸裂 | 集气瓶中的水: 排出瓶内的空气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】烹饪鱼时通常将鱼煎过后,再加少许食醋和酒,这是因为它们可以反应生成具有特殊香味的乙酸乙酯(化学式为C4H8O2),每个乙酸乙酯分子是由____个原子构成的,乙酸乙酯的相对分子质量是________在乙酸乙酯中碳元素和氧元素的最简质量比是 ______;17.6g乙酸乙酯中所含氧元素的质量为___________g 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法不正确的是( )
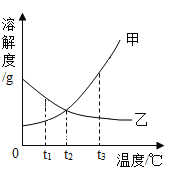
A. 甲的溶解度大于乙的溶解度
B. t1℃时,甲、乙的饱和溶液的溶质质量分数不相等
C. t2℃时,乙物质的饱和溶液降温至 t1℃时会转化为不饱和溶液
D. 当甲中含有少量乙时,可采用降温结晶的方法提纯甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一一种溶质),取废水样品200g,逐滴加入溶质质量分数为5%的氢氧化钠溶液,废水中硫酸的质量随加入氢氧化钠溶液质量变化如下图所示,

(1)要配制100g5%的氢氧化钠溶液,需氢氧化钠固体质量为___________g;
(2)计算该废水中硫酸的质量分数为_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com