
【题目】在实验探究课上,化学老师给了同学们一包红色粉末,该粉末是由Cu 、Fe2O3 、Fe(OH)3三种固体中的一种或两种组成,其中一个小组同学提出如下猜想并进行探究:
(提出猜想)红色粉末可能的组成有:
只有Fe2O3
②是Cu 、Fe2O3的混合物
![]() ③是Fe2O3 、Fe(OH)3的混合物
③是Fe2O3 、Fe(OH)3的混合物
(查阅资料)(1)2Fe(OH)3 Fe2O3 +3H2O
(2)无水CuSO4白色固体遇水变蓝
(3)Cu在FeCl3溶液中发生的反应:2FeCl3+Cu 2FeCl2+CuCl2
(实验探究)
(1)甲同学取适量红色粉末装入试管中,按图11进行实验,结果无水CuSO4没有变蓝,从而排除猜想中的 (填猜想中的序号)。
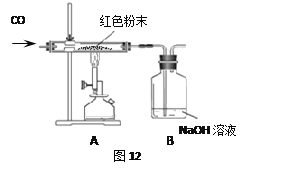
(2)乙同学为进一步确定红色粉末的组成,按图12称取少量红色粉末放入硬质玻璃管中,通入CO片刻,然后加热至完全反应,停止加热,继续通入CO冷却至室温。

(反思评价)
(1)实验时通入CO片刻后再加热的原因是 。
(2)实验过程中,A装置中发生反应的化学方程式是 。
(3)从环保角度看,图12装置存在的不足之处是: 。
(4)如果观察到A装置中红色粉末部分变黑,则猜想 正确(填序号)。
(拓展延伸)丙同学认为:在甲同学实验结论的基础上,还可以这样探究猜想①和②。取少量红色粉末于试管中,滴加足量稀盐酸,振荡后发现固体全部溶解,溶液变色,即可以排除猜想中的②。你认为丙同学的观点是否正确? (填“正确”或“不正确”),理由是
【答案】【实验探究】(1)③
【反思与评价】(1)防止玻璃管中的CO与空气混合受热发生爆炸(或其他合理答案均得分) (2)3CO+Fe2O3![]() 2Fe+3CO2 (3)没有进行尾气的处理 (4)②
2Fe+3CO2 (3)没有进行尾气的处理 (4)②
【拓展延伸】不正确、Fe2O3与盐酸反应得到FeCl3溶液,Cu又与生成的FeCl3反应得到FeCl2和CuCl2溶液(或Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu = 2FeCl2+CuCl2)
【解析】
本题是一道综合性探究题,利用物质的性质不同设计实验加以甄别,来探究红色粉末的组成,先分别探究其中是否含有Fe(OH)3、Fe2O3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究确定其组成.
根据【资料获悉】中的(1)(2)(3)和探究(1)可排除猜想中的③.
【反思评价】要考虑到CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.应考虑到CO有毒,排放到空气中会污染大气,显然,该装置没有对尾气进行处理.在探究的同时也出现了与上述高考题中相同的防倒吸及尾气处理等考点.同时考查了一氧化碳还原氧化铁的实验操作要点实验现象等,对氢气的还原性也进行了衍生.
解答:解:【实验探究】
(1)根据资料 2Fe(OH)3![]() Fe2O3+3H2O,白色无水CuSO4遇水变蓝;加热红色粉末,结果无水CuSO4没有变蓝,从而排除猜想中的含有Fe(OH)3的选项③;
Fe2O3+3H2O,白色无水CuSO4遇水变蓝;加热红色粉末,结果无水CuSO4没有变蓝,从而排除猜想中的含有Fe(OH)3的选项③;
【交流讨论】
根据CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.所以在装置A中先通CO气体的作用是:排净装置中的空气(或防止CO和装置中的空气混合受热发生爆炸);故答为:
(1)实验时通入CO片刻后再加热的原因是:防止玻璃管中的CO与空气混合受热发生爆炸.
(2)实验过程中,A装置中发生反应的化学方程式是:3CO+Fe2O3![]() 2Fe+3CO2.
2Fe+3CO2.
(3)从环保角度看,图12装置存在的不足之处是:没有进行尾气的处理.
(4)如果观察到A装置中红色粉末部分变黑,则猜想:②正确.
【拓展延伸】丙同学认为:在甲同学实验结论的基础上,还可以这样探究猜想①和②.取少量红色粉末于试管中,滴加足量稀盐酸,振荡后发现固体全部溶解,溶液变色,即可以排除猜想中的②.则丙同学的观点不正确,理由是:Fe2O3与盐酸反应得到FeCl3溶液,Cu又与生成的FeCl3反应得到FeCl2和CuCl2溶液(或Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2).
故答为:【实验探究】(1)③
【反思与评价】(1)防止玻璃管中的CO与空气混合受热发生爆炸(或其他合理答案均得分)
(2)3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
(3)没有进行尾气的处理
(4)②
【拓展延伸】不正确、Fe2O3与盐酸反应得到FeCl3溶液,Cu又与生成的FeCl3反应得到FeCl2和CuCl2溶液(或Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2)


科目:初中化学 来源: 题型:
【题目】(5分)甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。请回答:

(1)图中P点的意义是
(2)若甲中混有少量的乙,最好采用 的方法提纯甲
(3)使30℃接近饱和的甲溶液变成该温度下的饱和溶液,可采用的 一种方法是
(4)使50℃甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的是
(5)向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你认为“全部溶解”的原因可能是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年是俄国化学家门捷列夫发明元素周期表150周年,联合国将今年定为“国际化学元素周期表年”。元素周期表揭示了化学元素间的内在联系,使其构成一个完整体系。
(1)下图为氟元素在元素周期表中的信息和氟原子及镁原子的结构示意图。

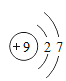
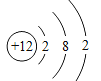
写出图中①代表的元素符号_____,镁属于_____(填“金属”或“非金属”)元素。
(2)由氟和镁两种元素组成化合物氟化镁的化学式为_____
(3)下列原子结构示意图中,与镁原子的化学性质最相似的是_____(填序号)。
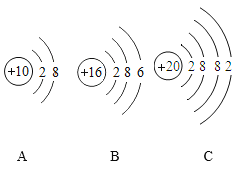
(4)已知原子的核外电子层数与元素所在周期表中周期的序数相同,则镁元素在元素周期表中排在第_____周期。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如下图所示。据图回答问题:
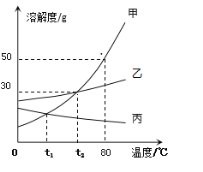
(1)80℃时,甲物质的溶解度是__________。
(2)欲将t1℃甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法:_____(任填一种)。
(3)t2℃时,把甲、乙、丙三种物质的饱和溶液降温到t1℃,溶质质量分数不变的是______。
(4)若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是__________。
(5)在80℃时,将150克甲物质的饱和溶液稀释成质量分数为20%的溶液需加水____ 克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1℃时,将m克硝酸钾和m克氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
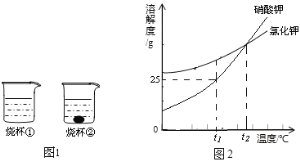
(1)在____℃时硝酸钾和氯化钾的溶解度相等;
(2)烧杯②中的上层清液是否达到饱和状态?______(填“是”、“否”或“无法判断”);
(3)t1℃时硝酸钾的饱和溶液稀释成10%的溶液需要的仪器是______;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A 烧杯①和烧杯②内上层清液中溶质的质量分数相等
B 将温度升高到t2℃时,两烧杯中的溶液都是不饱和溶液(不考虑水蒸发)
C 向烧杯②内上层清液中加入少量氯化钠,溶液的质量会增加
D 若t1℃时氯化钾的溶解度是a克,则a≧m﹥25
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】盐酸溶液中含有H2O分子、H+和Cl-,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。

滴加紫色石蕊溶液后的现象 | 结论 | |
第1孔 | 孔中溶液仍为紫色 | 水分子_________________ |
第2孔 | ____________________ | _______________________ |
第3孔、第4孔 | ____________________ | _______________________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下:
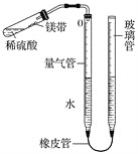
①取一段镁带样品,准确称得其质量为0.030 g;
②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器;
③_________________________;
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞;
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置;
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应;
⑦待冷却至室温后,再次记录量气管中液面位置;
⑧算出量气管中增加的气体体积为23.96 mL;
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式:____________________。
(2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。
(3)操作③是_________________________。
(4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。
(5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们的生活与化学密切相关,处处充满着化学知识。
(1)下列食物中,能提供大量维生素的是______(填字母序号)
A 牛奶 B 大米 C 蔬菜 D 食盐
(2)加钙牛奶中的“钙”是指钙元素、它是人体必需的__(填“常量”或“微量“)元素,身体一旦缺钙,可能患有的疾病是________(填“骨质硫松”或 “贫血”)。
(3)下列物品中,所使用的主要材料属于天然纤维的是______(填字母序号)
A 玻璃钢电缆桥架 B 棉布围裙 C 塑料保鲜袋 D 蚕丝被芯
(4)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________功能
(5)生产修正液需要用到钛白粉(TiO2)、工业上制取TiO2的方法是:7Cl2+3C+2FeTiO3(钛酸亚铁)==2X+2FeCl3+3CO2。请写出钛酸根离子化学符号:____________。
(6)氮氧化物(NOx)等气体破坏人类生存的环境。汽车尾气净化装置里装有Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。
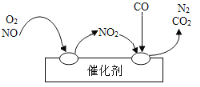
尾气净化装置中发生的总反应方程式为_________________,该反应中的氧化剂有____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
(查得资料)
(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
(2)饱和碳酸氢钠溶液不吸收二氧化碳。
(3)碱石灰的主要成分为氧化钙和氢氧化钠。
(设计实验)小组同学设计了如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的含量。
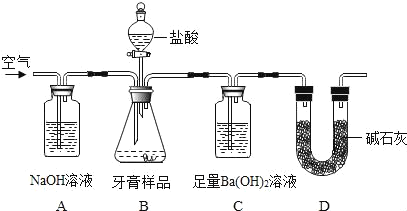
依据图示回答下列问题:
(1)B装置使用分液漏斗的优点是_____。
(2)A中氢氧化钠溶液的作用是_____。
(3)C中观察到有沉淀产生,反应的化学方程式为_____。
(4)实验过程中需持续缓缓通入空气,其作用有_____。
(解释与结论)将C中产生沉淀通过_____、洗涤、干燥、称量,通过计算求得牙膏样品中碳酸钙的含量。
(反思与评价)
反思实验过程,小刚同学提出应采取必要措施,提高测定准确度。他提出的下列各项措施中,不能提高测定准确度的是_____(填字母序号)。
a 在加入盐酸之前,排净装置内的CO2气体
b 放慢滴加盐酸的速度
c 在A﹣B之间增添盛有浓硫酸的洗气装置
d 在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(拓展延伸)小亮同学为确定A中溶质成分,进行了如表所示实验:
实验操作 | 实验现象 | 实验结论 |
(1)、取少量滤液于试管中,加入足量____ | 产生白色沉淀 | 溶质主要成分为Na2CO3和NaOH |
(2)、过滤,取少量滤液加入 | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com