
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。(包括表中空格)。
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。该反应的化学方程式为______。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(猜想与假设)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:______。
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。请指出不合理的猜想并说明理由,______。
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有______。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究。请完成实验报告:
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | ______ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)(1)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出[实验探究](2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是______;
②实验方案中也有一个是错误的,错误的原因是______。
(2)在分析反应后所得溶液中溶质成分时,除了考虑生成物外,还需要考虑______。
【答案】2NaOH+H2SO4=Na2SO4+2H2O 有Na2SO4和NaOH 猜想三不合理,这是因为硫酸和氢氧化钠不能共存 氢氧化钠 产生气泡 把pH试纸直接伸入待测液中 硫酸钠也能和氯化钡反应生成白色沉淀 反应物是否过量
【解析】
氢氧化钠和稀硫酸反应生成硫酸钠和水,硫酸钠和氯化钡反应生成硫酸钡和氯化钠,碳酸钠和硫酸生成硫酸钠和水和二氧化碳,pH试纸不能直接伸入待测液中。
[演示实验]
氢氧化钠和稀硫酸反应生成硫酸钠和水,该反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O。
故填:2NaOH+H2SO4═Na2SO4+2H2O。
[猜想与假设]
猜想一:恰好完全反应时只有Na2SO4
猜想二:稀硫酸过量时有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:氢氧化钠过量时有Na2SO4和NaOH。
猜想三不合理,这是因为硫酸和氢氧化钠不能共存。
故填:有Na2SO4和NaOH;猜想三不合理,这是因为硫酸和氢氧化钠不能共存。
[实验探究]
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠,这是因为如果含有氢氧化钠,会产生蓝色沉淀。
(2)试纸变色,对比比色卡,pH<7,说明溶液显酸性,即溶液中含有硫酸;
滴加Na2CO3溶液,产生气泡,是因为碳酸钠和稀硫酸反应生成了二氧化碳气体,实验过程如下所示:
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 产生气泡 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
[评价反思]
(1)① 实验操作中的错误是把pH试纸直接伸入待测液中。
②实验方案中也有一个是错误的,错误的原因:硫酸钠也能和氯化钡反应生成白色沉淀。
(2)在分析反应后所得溶液中溶质成分时,除了考虑生成物外,还需要考虑反应物是否过量。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:初中化学 来源: 题型:
【题目】以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如图:
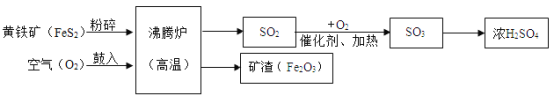
(1)将黄铁矿粉碎,目的是_____。
(2)流程中SO2转化为SO3的化学方程式为_____。
(3)实验室稀释浓硫酸的方法是_____。
(4)炉渣(Fe2O3)在工业上可用来炼铁,反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图装置可以做 CO还原Fe2O3的实验并检验该反应的气体生成物, 已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。

(1)写出B装置玻璃管内反应的化学方程式___________。
(2)从环保角度考虑,请写出一种尾气处理方法。___________
(3)若没有A装置,则该实验不能达到检验气体生成物的目的,请说明原因。___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】厨房中;使用的食用碱(主要成分是碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学对其组成展开探究。他们实验的过程和数据如图所示:
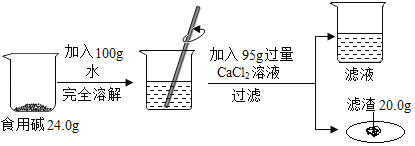
请你据图
(1)反应后滤液中含有的溶质是_____(写化学式)
(2)通过已知数据,能求出的量有_____(写字母序号)
a反应后滤液的总质量
b参加反应的氯化钙的质量
c样品中碳酸钠的质量
d氯化钙溶液中溶质的质量分数
(3)计算食用碱样品碳酸钠的质量分数_____(写出计算过程,结果保留到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析归纳总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
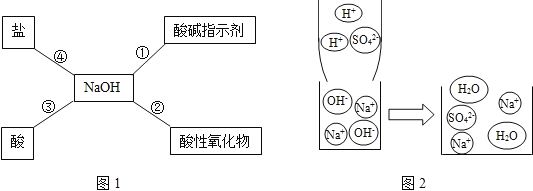
(1)为了验证反应①,小明将无色酚酞溶液滴入NaOH溶液中,溶液_____。
(2)依据反应②说明NaOH必须密封保存,否则在空气中要变质,其化学方程式为:_____。要检验该氢氧化钠是否变质,我们可以选择一种碱,该碱的化学式为_____,反应的化学方程式是_____。
(3)小明用微观示意图(图2)来说明反应③的发生,用化学方程式表示为:_____;从该图可以看出,反应前后没有发生变化的微观粒子有_____。
(4)为了验证反应④能够发生,你不可能选择的物质是_____。
A Na2CO3 B NH4Cl C CuSO4 D MgCl2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锌粒投入硫酸铜溶液中,观察到的现象是_________除此之外,细心的同学还看到有一种无色无味气体产生。为确定气体的成分,进行下列实验探究。
【猜想与假设】:依据_______可知气体可能是SO2、O2、H2中的一种或几种。
【查阅资料】:
①SO2能使酸性高锰酸钾溶液褪色。
②O2+4KI+4HCI==2I2+4HCI+2H2O,淀粉遇I2变蓝。
③H2、CO等气体能将氧化铜还原成铜。
【实验验证】:
(1)将气体通入酸性高锰酸钾溶液中,无现象,则该气体中无SO2能。小明同学认为没有必要做这个实验就可以确定无SO2生成,他的依据是_________________.
(2)用下列所示实验检验氢气和氧气(浓硫酸主要用于干燥气体):
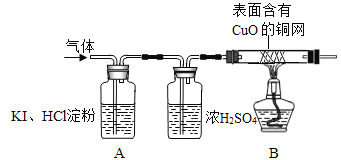
A中观察到________,证明无O2:B中观察到_________,证明该气体是H2.
【实验反思】:大家认为在加热之前,应对气体先_________以确保安全。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
(实验探究)在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH 溶液。实验装置和现象如图所示。请你一起参与。
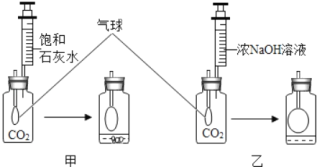
(现象结论)甲装置中产生的实验现象(用化学方程式表示)_____,解释通常用石灰水而不用NaOH 溶液检验CO2的原因_____;乙装置中的实验现象是_____,吸收CO2较多的装置是_____。
(计算验证)另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH.因此,他认为通常吸收CO2应该用饱和石灰水。
(思考评价)请你对小李同学的结论进行评价:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】书写化学方程式:
(1)电解水_____。
(2)氢气燃烧_____。
(3)二氧化碳和水反应_____。
(4)二氧化碳和石灰水反应_____。
(5)甲烷充分燃烧_____。
(6)乙炔充分燃烧_____。
(7)硝酸银与盐酸反应_____。
(8)电解氯化镁_____。
(9)铝的燃烧_____。
(10)一氧化碳还原氧化铁_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com