
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,利用此知识分析即可.
解答 解:在金属活动性顺序中,金属的活动性强弱是:镁>锌>铜,由题意可知向Cu(NO3)2、Mg(NO3)2的混合溶液中加入一定量的锌粒,锌不能与Mg(NO3)2反应,锌可以和硝酸铜反应生成铜和硝酸锌;由于完全反应后过滤.滤液仍呈蓝色,说明了滤液中含有Cu(NO3)2,加入的锌完全都发生了反应.所以则滤渣中一定含Cu,一定不含Mg、Zn;滤液中一定含Mg(NO3)2、Zn(NO3)2、Cu(NO3)2.
故答案为:Cu;Mg、Zn;Mg(NO3)2、Zn(NO3)2、Cu(NO3)2.
点评 此题考查了金属活动顺序表中镁、锌、铜的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCl2、HCl、Na2SO4、NaNO3 | B. | HCl、BaCl2、Na2SO4、Na2CO3 | ||
| C. | NaOH、KNO3、CuSO4、NaCl | D. | Na2CO3、CaCl2、Na2SO4、KCl |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
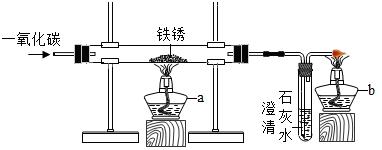 铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气(或O2、H2O)等发生化学反应的过程,铁锈的主要成分是Fe2O3•xH2O.某化学兴趣小组在实验室中用足量一氧化碳还原铁锈,装置如图,酒精灯b的作用是点燃多余的一氧化碳,防止污染空气.
铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气(或O2、H2O)等发生化学反应的过程,铁锈的主要成分是Fe2O3•xH2O.某化学兴趣小组在实验室中用足量一氧化碳还原铁锈,装置如图,酒精灯b的作用是点燃多余的一氧化碳,防止污染空气.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 同学们在初中化学实验室中发现一瓶久置的、瓶口有白色固体、瓶塞丢失的无色溶液,如图所示.已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定该溶液的成分,同学们进行了如下探究:
同学们在初中化学实验室中发现一瓶久置的、瓶口有白色固体、瓶塞丢失的无色溶液,如图所示.已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定该溶液的成分,同学们进行了如下探究:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 金属在我们生活中随处可见,其中包含很多知识.
金属在我们生活中随处可见,其中包含很多知识.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com