
科目: 来源: 题型:
【题目】同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
查看答案和解析>>
科目: 来源: 题型:
【题目】探究一:气体的制取
实验室中进行实验需要制取少量的乙炔气体,小婷同学对制取乙炔的方法进行了探究。请你参与她探究过程并回答有关问题。
【查阅资料】小婷同学首先查阅了相关资料,获得了如下信息:
①乙炔(C2H2)是一种无色、无味、无嗅的气体,比空气轻,微溶于水,易燃烧。
②(A)天然气在电炉中高温下反应可生成乙炔:2CH4高温 C2H2+3H2
(B)固体碳化钙(CaC2)与水反应可生成乙炔:CaC2+2H2O=Ca(OH)2+C2H2↑
【选择装置】
(1)实验室应选择制取乙炔气体的反应原理你选择 上面 的是______(填“A”或“B”),选择该反应的理由是_________________。
(2)实验室中有以下两套气体的发生装置(下图)。

制取乙炔应选择的装置是___________(填“甲”或“乙”)。你选择此装置的理由是___________。
(3)若用下图装置收集乙炔气体,气体应该从______(a或b) 进入。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用 化学符号 表示:
①保持乙炔化学性质的微粒_____;②3个氯化氢分子______;③氯化钙的构成微粒______ ④碳酸中氢元素的化合价为+1价____ ;⑤干冰的化学式______
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是通过白磷燃烧来验证质量守恒定律的实验,下列说法错误的是
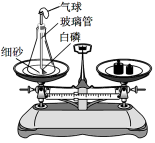
A.反应前锥形瓶内白磷和氧气的总质量一定等于反应后生成五氧化二磷的质量
B.白磷燃烧结束,锥形瓶应冷却后再放在天平上称量
C.实验过程中气球先变大后变瘪
D.瓶底的细砂起隔热作用
查看答案和解析>>
科目: 来源: 题型:
【题目】某粗盐中除NaCl以外还含有少量杂质MgCl2,为了测定粗盐中MgCl2的质量分数。取固体样品50.0g完全溶解于150.0g水中,并向其中逐渐加入一定浓度的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如图所示:

注:发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
请根据相关信息完成下列计算:
(1)反应完全时,生成氢氧化镁的质量为_____g;
(2)在粗盐中氯化镁的质量分数;_____
(3)恰好完全反应时得到的溶液中溶质的质量分数。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____.
(2)操作I的名称是_____.“干燥”过程中温度不宜过高的原因是_____(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;不用稀H2SO4酸化,反应的化学方程式为:3K2 MNO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+2H2O;工业上不采用稀H2SO4酸化的原因是_____.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2 MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】水在实验室中的应用。
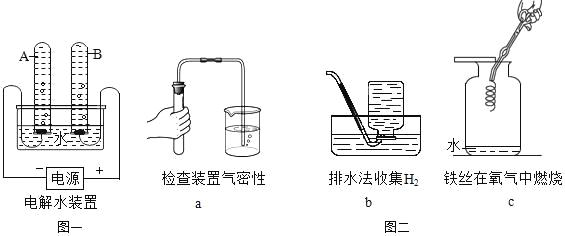
(1)水的电解
①宏观现象:按如图一所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_____,反应的符号表达式为_____。
②微观该反应中发生分解的微粒名称是_____。
③结论:水由_____组成。
(2)水的应用
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
②下列实验中,对水的主要作用分析正确的是_____(填字母,可多选)
A a图中的水封住试管及导管中的空气,并便于观察容器内外气压变化
B b图集气瓶中的水排尽空气且便于观察H2何时集满
C c图中的水防止高温熔融物炸裂集气瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】味精是主要成分谷氨酸钠,易溶于水,其化学式是C5H8NO4Na,与硝酸银溶液不反应。味精中还含有氯化钠(味精中其他成分不考虑),氯化钠与硝酸银溶液发生复分解反应,生产氯化银白色沉淀。回答下列问题:
(1)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是________(填字母)。
A.10mL B.50mL C.100 mL
(2)如图是配制过程,正确的操作顺序为________((填序号)。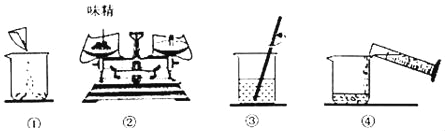
(3)为测定味精中NaCl的质量分数,进行如下实验:
在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液的谷氨酸钠质量分数________((填“偏大”、“偏小”或“无影响”)
(4)为测定味精中含有氯化钠的质量分数,继续实验:
①向所配制的50g溶液中加入过量的________(溶液(填化学式)充分反应。
②然后进行________((填操作名称)、洗涤、干燥、称量白色沉淀固体。经精确测定白色沉淀的质量为2.87g,则该味精中氯化钠的质量分数为_________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是不含结晶水的a、b、c 三种物质的溶解度曲线,下列说法正确的是 ( )

A.t2℃时,将50g a 物质加入到50g 水中充分搅拌,得到100g a的饱和溶液
B.用等质量的a、b、c 三种固体配制成t2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液 > b溶液 > a溶液
C.将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是: b > a = c
D.将t2℃时a、b 两种物质的饱和溶液降温到t1℃时,析出晶体的质量: a > b
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们从山上采集到一种石灰石样品,为了测定石灰石样品中碳酸钙的质量分数(石灰石中的杂质不与盐酸反应,也不溶于水),取45g石灰石样品,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示,请计算:

(1)45g这种石灰石样品中碳酸钙的质量是_____g
(2)本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由_____。
(3)列式计算45g石灰石与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com