
科目: 来源: 题型:
【题目】甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全球最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想] 甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
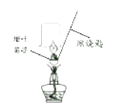
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是____________________________。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
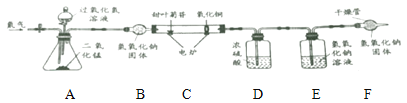
(1)实验前要通一会儿氮气,目的是_________________。
(2)A装置中发生反应的化学方程式为__________________________。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为___g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是_____________。 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将含有可溶性杂质的某氯化钠样品3g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液(杂质不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如右图所示。试计算:
(提示:NaCl + AgNO3 = AgCl↓+ NaNO3 )

(1)恰好完全反应时生成沉淀质量为 g;
(2)硝酸银溶液中溶质的质量分数是多少?
查看答案和解析>>
科目: 来源: 题型:
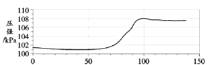
【题目】在密闭容器中,分别用温度和压强传感器测定铝片和稀盐酸反应过程中的图像如下,下列结论不正确的是( )
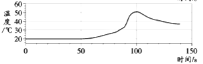
A. 反应过程中有热量放出
B. 0~50s,变化不明显,是因为铝表面有一层致密氧化铝薄膜 发生稀盐酸与Al的反应
C. 60s~100s气体压强增大,是因为温度升高
D. 100s后温度降低是因为反应停止
查看答案和解析>>
科目: 来源: 题型:
【题目】将100g氯化钙样品(含有碳酸钙)加入150g盐酸中完全反应,气体全部逸出,得到245.6g溶液。则:
(1)产生的气体质量为________g。
(2)反应后溶液中溶质的质量分数________。 (计算结果保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.根据下列实验装置图,回答问题:
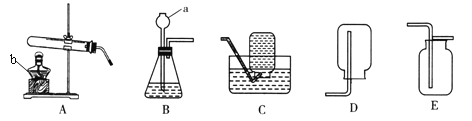
(1)实验仪器的名称:a_______________;b_________________。
(2)实验室用高锰酸钾制取氧气的化学方程式为:________________________________________,发生装置应该选用_______(填序号),该装置有一处不足,请改正:____________________________。要收集到较纯净的氧气,应该选用装置__________(填序号),若用该装置收集的氧气也不纯,原因可能是___________。
II.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体,能与稀硫酸反应:CuO+H2SO4═CuSO4+H2O
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)若碳还原氧化铜得到的固体全部是铜,请写出化学反应方程式______________________。
(2)实验1﹣2中,证明生成CO2的现象是_________________________________________。
(3)实验1的目的是____________________________________________________________。
(4)实验2的结论是______________________________________。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是________________________。
(6)如何检验2﹣4的红色固体中是否含Cu2O,请写出实验步骤、现象和结论 ________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以黄铁矿(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
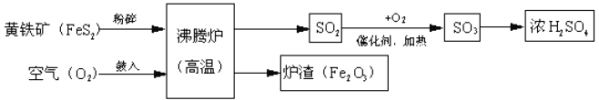
(1)写出流程图中一种氧化物的名称___________。
(2)将黄铁矿粉碎,目的是_________________________________________________。
(3)请写出黄铁矿在沸腾炉里发生的化学反应方程式_______________________________________。
该反应中的_____________(填元素符号)从反应前到反应后化合价升高。
(4)该生产流程的炉渣可以做工业炼铁的原料,请写出工业炼铁反应原理的化学方程式_________。
(5)实验室中经常使用到稀硫酸,用浓硫酸稀释时,是先把水加入到烧杯中,再将浓硫酸沿烧杯壁慢慢地加入到水中,并不断用玻璃棒搅拌,这个过程玻璃棒的作用是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】没有水就没有地球上的生命,人类的日常生活离不开水。
(1)日常生活中常用的净化水的操作有沉淀、过滤、吸附、蒸馏等,其中能把硬水软化的操作是_________。
(2)写出电解水的化学反应方程式:___________;该反应的基本类型是_____。
(3)A、B、C三种固体的溶解度曲线如图所示:①P点的含义是______________;②t1℃时,将10gA物质加入50g水中,充分溶解后,形成溶液的质量为____ g;
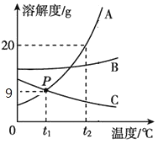
③t2℃时,将A、B、C物质饱和溶液各100克,分别蒸发10克水后,剩余溶液质量分数由大到小的顺序是________。
(4)氢氧化钠是实验室中常见的碱,现用氢氧化钠固体配制溶质质量分数为40%(密度为1.43g/mL)氢氧化钠溶液100mL,过程如下:
①计算:需称量氧氢化钠固体__________ g,加水体积为___________mL。
②称量:如图称量氢氧化钠固体的操作中,有一处明显错误是________________________。
③溶解:将正确操作称量好的氢氧化钠固体加入烧杯中,并将量取的蒸馏水倒入烧杯中,并用玻璃棒搅拌,使它完全溶解。经检测,所配制溶液的溶质质量分数偏小,其原因可能是_________(填序号)。

①氢氧化钠固体不纯 ②量取水时,俯视读数
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年5月9日,我国“高分五号”卫星发射成功。
(1)20世纪前,中国人发明的黑火药是世界上唯一的火箭推进剂,其反应为S+2X+3C=K2S+N2+CO2,请写出X的化学式_________,1940年美国研制出高氯酸钾(KClO4)、沥青固体复合推进剂,高氯酸钾是由_________(填“分子”、“原子”或“离子”)构成的。
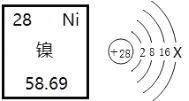
(2)“高分五号”用钛镍形状记忆合金制作卫星天线。如图是镍元素在元素周期表中的信息以及原子结构示意图。镍元素的相对原子质量为____________,X的数值是_____。
(3)“高分五号”是我国首颗对大气中二氧化硫、二氧化氮、甲烷(CH4)等多个环境要素进行监测的卫星,二氧化硫等气体的大量排放会造成酸雨,请计算二氧化硫中氧元素的质量分数__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,打开止水夹,将液体A滴入试管②中与固体B 接触。若试管①中的导管口没有气泡产生,则液体A和固体B的组合可能是下列中的
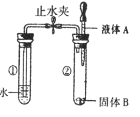
A. 过氧化氢溶液和二氧化锰B. 水和硝酸铵
C. 水和氢氧化钠D. 稀盐酸和石灰石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com