
科目: 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )

A. 20℃时,甲、乙两溶液的溶质质量分数一定相等
B. 将40℃时甲的一定量饱和溶液降温至20℃,溶液质量不变
C. 甲的溶解度大于乙的溶解度
D. 40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在2018全国两会上,农业部部长韩长赋在人民大会堂“部长通道”回答记者提问时说,农药和化肥确实对粮食增产发挥了重要作用,“十三五”开始,我国大力开展农药减量,效果明显。2016年,全国农药使用量负增长。
谈到农药,人们可能想到农药对人体健康和环境的危害,其实农药在农业生产上起着重要的作用。目前市售蔬菜农药残留量虽然已达到国家标准,但通过科学的清洗方法仍可进一步降低农药残留。
实验人员分别选取含甲、乙农药的蔬菜,研究了不同的清洗方法对农药的去除率的影响。
清水浸泡。图1呈现出两种农药的去除率随浸泡时间的变化。
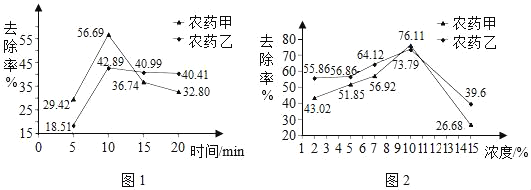
洗洁精清洗。实验选择了6种洗洁精进行测试,结果表明多数洗洁精对农药的去除率可达到60%以上,最高可达到84%。
碱性溶液。浸泡食用碱溶液有利于农药分解,图2表示不同浓度的食用碱溶液对农药的去除率的影响。
希望同学们可以选择科学的清洗方法,更加安全的食用蔬菜。
依据文章内容,结合所学化学知识,回答下列问题。
(1)农药和化肥对粮食增产发挥了重要作用,请你写出一种氮肥:_____(合理即可)。
(2)依据图1分析去除农药残留的最佳浸泡时间是_____。
(3)食用碱主要是碳酸钠和碳酸氢钠,它们的溶液的pH_____7(填“>”或“<”)。测定溶液pH的正确方法是_____。
(4)用食用碱溶液浸泡含有农药甲的蔬菜时,要想超过清水浸泡的最大去除率,可以选取的浓度是_____(填序号,下同)。
A 2% B 5% C 10% D 15%
(5)下列说法正确的是_____。
A 采用清水浸泡去除农药的时间不宜过长
B 多数洗洁精对农药的清洗效果比清水浸泡的好
C 食用碱的去除效果较好,是因为在浸泡过程中农药发生了化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下图A—F都是初中化学常见的物质。图中的反应条件已略去。已知A常温下为液体,F是一种难溶性的蓝色固体。(资料:难溶性碱受热易分解为两种氧化物,反应中各元素化合价不变)。请回答下列问题。
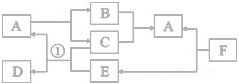
(1)A的名称是________;F的化学式为__________。
(2)反应①的现象为_______________________________;
(3)写出另一个F能发生的反应方程式_______________________,该反应属于_________反应(填基本反应类型)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像与所对应操作相符的是
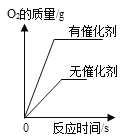
A.用两份等质量、等质量分数的过氧化氢溶液制取氧气
B.向一定质量分数的盐酸中不断加水
C.向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸
D.向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜是铜和锌所组成的合金,用途广泛。某兴趣小组为探究某黄铜合金的组成,取20g粉末状矿黄铜合金样品,把60g稀硫酸平均分成三等份,分三次(每次20g)加入样品中,均有气体产生,充分反应后,过滤出固体,将其用蒸馏水洗涤、干燥、称量,得实验数据如表:
第一次 | 第二次 | 第三次 | |
剩余固体的质量/g | 16.75 | 13.5 | 12.4 |
计算:
(1)该黄铜合金中,锌的质量分数为_____。
(2)20g实验所用稀硫酸中硫酸的质量为_____。
(3)第二次实验后,将第一、二次实验所得滤液合并(含洗涤用蒸馏水53.7g),求所得溶液中溶质的质量分数(不考虑过程中的损失)。____(写出计算过程,结果保留到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】重庆一中学化学兴趣小组对物质的性质和组成进行相关探究。
(1)甲组同学用氧化铜与足量的碳粉利用图1所示装置在隔绝氧气的条件下进行实验,并对生成气体的成分进行探究。
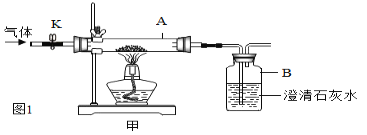
(提出问题)生成的气体中是否含有一氧化碳?
请用化学方程式表示出生成气体中可能有一氧化碳的理由:_____。
(实验与讨论)
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应
③甲组同学想除尽生成的气体中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是_____(填序号)。
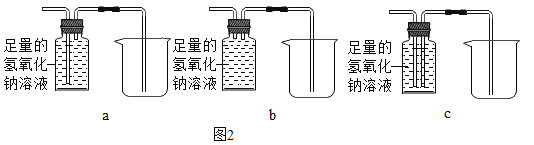
(实验求证)
为了检验生成的气体中含有CO,将收集在集气瓶中的气体排出,再通入图甲所示的装置进行实验,A中的固体改用用氧化铜,B中溶液仍为澄清石灰水,若A中现象为_____,B中澄清石灰水变浑浊,可说明气体样品中含有一氧化碳。
(实验反思)
碳粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳与氧化铜的质量之比_____(填“大于”、“等于”或“小于”)3:40
(2)乙组同学测定水中氢、氧元素的质量比(已知:H 2+CuO![]() Cu+H2O)
Cu+H2O)
根据如图3进行实验,反应后测得A中玻璃管(含药品)质量减少ag,B中U形管(含药品)质量增加bg。
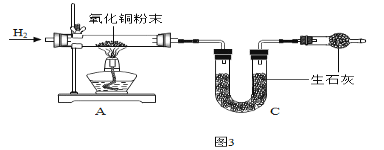
①水中氢、氧元素的质量比是_____(用含a、b的式子表示)。
②下列因素中,对测定结果有影响的是_____(填序号)。
A CuO粉末不干燥 B CuO没有完全转化为Cu C 没有C装置
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是初中化学常见的实验,请回答下列问题。
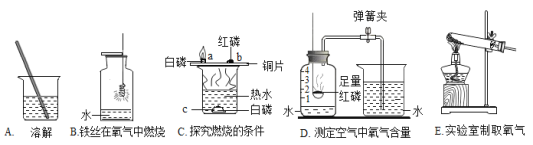
(1)实验A中玻璃棒的作用是_____。
(2)实验B中水的作用是_____。
(3)实验C中水的作用是提供热量和_____。
(4)实验D中反应的化学方程式为_____。
(5)实验E中制氧气的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】竖炉炼铁是一种重要的炼铁方法,其工艺流程如图所示。
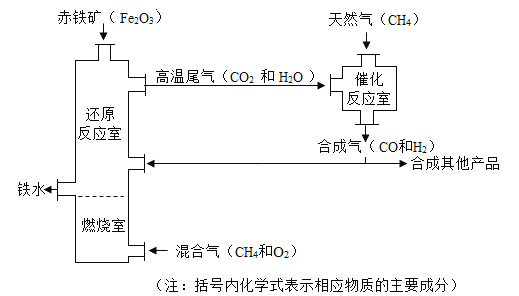
(1)赤铁矿属于____________(填“纯净物”或“混合物”)。
(2)用化学方程式表示竖炉内进行的反应:
a.还原反应室内____________________________________(任意选择一个)。
b.燃烧室内____________________________________。
(3)下列说法正确的是____________(填序号)。
A.加入的铁矿石要进行粉碎,目的是加快反应速率和提高原料利用率
B.该工艺流程中,可循环利用的物质有高温尾气(CO2和H2O)和CH4
C.燃烧室内进行的反应为炼铁提供了大量热量
D.竖炉炼铁得到的产品为纯铁
查看答案和解析>>
科目: 来源: 题型:
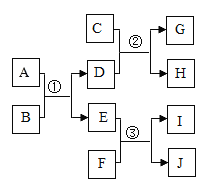
【题目】A﹣J是初中化学常见物质,它们之间的转化关系如图所示(反应条件已略去)。其中G是大理石的主要成分,A为红棕色化合物,I为红色单质,B、D为组成元素相同的气体。
请回答下列问题:
(1)I的化学式为_____。
(2)反应①的反应化学方程式为_____。
(3)反应②的反应化学方程式为_____。
(4)反应③的基本反应类型为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
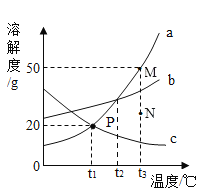
(1)t1℃时,把80g物质a加入到20g水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(2)欲使a物质的溶液从M点转化为N点,可采取的措施是_____。
(3)将P点对应的c物质的溶液升温到t 3℃,其溶质质量分数_____(填写“变大”、“变小”或“不变”)。
(4)将t3℃时a、b、c三种物质的饱和溶液恒温蒸发相同质量的水,析出晶体的质量最小的是_____(填物质序号)。
(5)t3℃时,将等质量的a、b、c三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com