
科目: 来源: 题型:
【题目】归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如下图。结合此图回答下列问题:
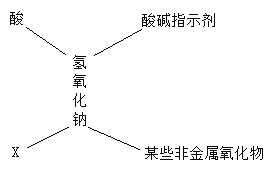
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为______,所以要密封保存。实验室须密封保存的物质还有_______(填一种)。
(2)写出能与氢氧化钠溶液反应的X中的一种物质_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学元素与人体健康的关系十分密切、人体缺碘会引起________。日常生活中通常食用海带、加碘盐预防碘元素不足。下图是市场上常见加碘盐的配料表,据此回答:碘酸钾中所含的常量元素是______,碘元素的质量分数是______(精确到0.1%)。为了维持生命和健康必须摄取营养素,富含蛋白质的常见食物有________(写一种)。
配料:氯化钠(NaCl)
碘酸钾(KIO3)
含量:氯化钠94%
含碘量:30mg/kg
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示的实验方案设计,不能达到实验目的的是( )
A. 探究燃烧的条件
探究燃烧的条件
B.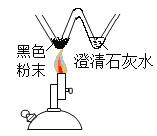 探究木炭还原氧化铜
探究木炭还原氧化铜
C.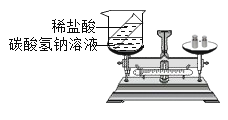 探究质量守恒定律
探究质量守恒定律
D. 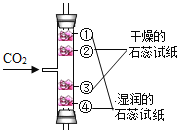 探究CO2能与水反应且密度比空气大
探究CO2能与水反应且密度比空气大
查看答案和解析>>
科目: 来源: 题型:
【题目】影响化学反应速率的因素很多。下列图像表达的化学反应过程,与实际情况不相符的是( )
选项 | A | B | C | D |
化学反应 | 等质量的镁片和铝片分别与足量相同的稀硫酸反应 | 等质量相同的过氧化氢溶液分别在有、无 | 等质量不同浓度的盐酸分别与足量相同的锌片反应 | 等质量形状不同的大理石分别与足量相同的稀盐酸反应 |
图像 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用二氧化碳制取重要的化工原料乙烯的微观过程如图所示下列说法正确的是( )
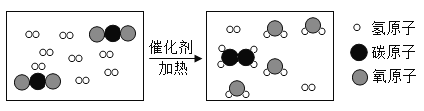
A.该反应属于置换反应
B.反应前后各元素的化合价均不变
C.参加反应的两种分子的个数比为2:9
D.一定条件下,无机化合物可转化为有机化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。下列说法正确的是( )
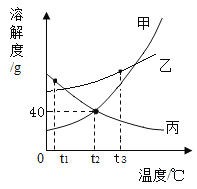
A.三种物质溶解度的大小关系是甲乙丙
B.![]() 时甲和丙的饱和溶液中溶质的质量分数相等,均为40%
时甲和丙的饱和溶液中溶质的质量分数相等,均为40%
C.![]() 时将三种物质的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系是乙甲丙
时将三种物质的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系是乙甲丙
D.![]() 时用等质量的甲、乙、丙分别配制饱和溶液,所得饱和溶液的质量关系是丙乙甲
时用等质量的甲、乙、丙分别配制饱和溶液,所得饱和溶液的质量关系是丙乙甲
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列符号或图示的说法正确的是( )
①![]() ②
②![]() ③
③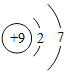 ④
④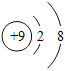 ⑤
⑤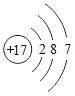 ⑥
⑥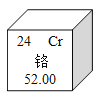
A.①表示两个氧原子
B.由⑥可知铬的相对原子质量为52.00g
C.②和④均表示阳离子
D.③和⑤表示的元素在形成化合物时通常显-1价
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
部分钙、镁化合物溶解性表(20℃) | |||
| OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
(查阅资料) 天然水中含有![]() 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
(提出猜想)水垢的主要成分一定有CaCO3和_____(填化学式),可能含有Ca(OH)2和_____。
(设计方案)
实验1 确定水垢中是否含有 Ca(OH)2
实验步骤 | 现象 | 结论 |
在少量研体的水垢中,加入适量的蒸馏水充分搅拌、过滤,在滤液中加入Na2CO3溶液 | ___________ | 一定不含Ca(OH)2 |
实验2:确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。

其主要实验步骤如下:称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要分为CaO和NaOH,不考虑装置内空气对实验的影响)。
(实验讨论)
(1)反应结束后打开止水夹K,缓缓鼓入空气的目的是___________。A、B装置之间__________设置干燥装置。(填“要”或“不要”)其理由是____________。
(2)装置B盛放稀盐酸的仪器作用是_________________。
(3)装置B中生成气体的反应的化学方程式为_______________。
(4)装置B中生成CO2的质量为_________g,通过计算说明水垢中_________含MgCO3(填字母)。
A 一定不 B 一定 C 可能 D 无法确定
计算过程(已知CaCO3相对分子质量为100。MgCO3相对分子质量为84):___________
实验3:确定水垢中是否有Mg(OH)2
(5)另取质量为1.25g水垢,加入3.65%稀盐酸与之反应,测得消耗稀盐酸mg,结合上述实验,判断当m的值满足____________条件时,水垢中一定含有Mg(OH)2。写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
(物质制备) 利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式:
FexOy+yH2![]() xFe+yH2O、Fe3C+2H2
xFe+yH2O、Fe3C+2H2![]() 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式:__________________;
(2)焙烧中加入焦炭的作用:__________________、________________。(写出两条)
(含量测定)为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。
已知3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
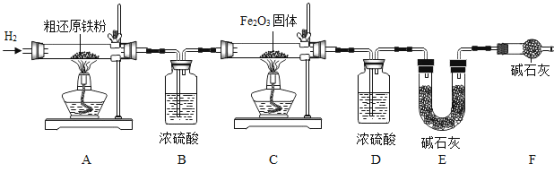
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再缓缓通入少量H2; ⑦再次称量必要装置的质量。
操作的先后顺序是①→______→______→______→______→______→⑦。
步骤②和③能否交换?________(填“能”或“不能”),原因是_________________。
(4)步骤⑤和⑥能否交换?________(填“能”或“不能”),原因是_________________。
(5)装置F的作用是___________,若缺少装置F,则所测氧元素质量分数将______(选填“偏大”、“偏小”或“不变”下同),碳元素质量分数将_________。
(6)粗还原铁粉样品质量为5.0g,装置B、E分别增重0.54g和0.44g,则样品中氧元素质量分数为________;碳元素的质量分数为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂用废硫酸制备![]() 的流程如下:
的流程如下:
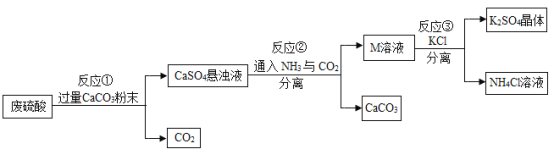
(1)生产上将CaCO3研成粉末的目的是________,欲达此目的,还可采用的方法是________。(任写一条)
(2)上述流程中,可循环使用的物质是________________。(填化学式)
(3)写出反应①中主要的化学方程式________________。
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是____________。
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是________(填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com