
科目: 来源: 题型:
【题目】氯化钡是一种可溶性重金属盐。工业上用毒重石(主要成分是BaCO3)制备氯化钡晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案,实验流程如图所示。(该毒重石样品所含杂质难溶于水,不与酸反应。)

(1)步骤①中发生反应的化学方程式为_____。
(2)滤液Ⅱ是30℃时氯化钡的_____溶液(选填“饱和”或“不饱和”);洗涤氯化钡晶体最适宜的洗涤剂是_____(填字母序号)。
A 30℃水 B 30℃饱和氯化钠溶液 C 30℃饱和氯化钡溶液
(3)关于上述实验方案的相关内容,下列说法不正确的是_____(填字母序号)。
A 氯化钡是一种有毒的物质,使用时应注意安全
B 该实验流程中得到的副产品二氧化碳是重要的化工原料
C 可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石,制备氯化钡晶体
D 步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染
(4)某同学提出,步骤③将滤液Ⅰ浓缩时会产生气体污染物,其化学式为_____。为防止污染,需要对滤液Ⅰ处理后再浓缩。处理滤液Ⅰ用到稍过量甲试剂,该试剂是_____(填字母序号)。
A Ba(OH)2 B BaCl2 C Ba(NO3)2 D BaCO3
(5)实验室有一份混有碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(如图为Ba(OH)2和Ca(OH)2的溶解度曲线):
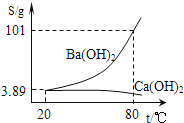
①高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。碳酸钡和碳酸钙化学性质相似,写出碳酸钡高温分解的化学方程式_____。
②将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是_____(选填字母);
A 冷却过滤 B 趁热过滤
③将“②”中滤液冷却结晶并过滤,得到的Ba(OH)2固体中不会含Ca(OH)2,因为_____。
④将“③”中制得的固体溶于水制成溶液。并向制得的溶液中滴加酚酞试剂,再通入二氧化碳。当观察到_____时,Ba(OH)2恰好全部生成BaCO3沉淀,即可停止通二氧化碳。
⑤滤出碳酸钡沉淀,经_____(填一种操作)、干燥后即得到纯净的碳酸钡。
查看答案和解析>>
科目: 来源: 题型:
【题目】小苏打和食盐是厨房中常用物质。现有一包白色固体,可能由 NaHCO3 和 NaCl 中的一种或两种组成。某科学小组同学展开了系列拓展性研究。
(一)定性
(实验目的)确定白色固体的组成
(实验方案)

(实验结论)该白色固体由_____组成;
(1)实验步骤①中选用稀硝酸而不用稀盐酸的原因是_____;
(2)实验步骤②中生成白色沉淀的化学反应方程式为_____。
(二)定量分析
(实验目的)测定该白色固体中 NaHCO3 的质量分数
(实验方案)用气体法测定样品中 NaHCO3 的质量分数。实验装置如下:
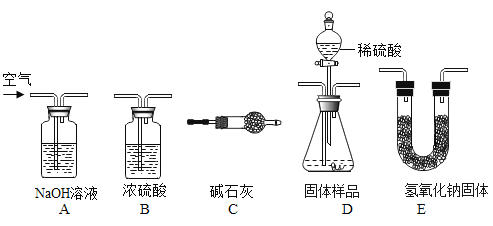
(1)用上述装置完成本实验,装置的连接顺序是 A→_____→_____→_____→C(填装置的字母编号,不重复使用);
(2)D 装置中发生反应的化学方程式为_____;
(3)如果没有经过 A 装置而直接通入空气,会使测量结果_____(填“变大”、“变小”或“不变”);
(4)C 装置的作用是_____;
(5)D 装置中的反应完全后,称量前,还需要进行的实验操作是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在抗击新型冠状病毒肺炎战役中做好杀菌消毒工作至关重要。下面是几种常见的消毒剂:
(一)酒精(C2H5OH)
(1)在配制 75%的医用酒精溶液时发现 75mL 的酒精和 25mL 的水混合后体积小于 100mL,其原因是________;
(2)在室内使用酒精消毒剂时,遇到明火易发生燃烧甚至爆炸。从燃烧的条件分析,明火的作用是______,酒精完全燃烧的化学方程式是______。
(二)过氧乙酸溶液 其标签上的部分文字如图。

(1)从标签上的成分信息可以推知,过氧乙酸溶液受热时容易发生_____;
(2)一瓶这种溶液中含溶质过氧乙酸_____g;
(3)过氧乙酸中碳、氢、氧元素的质量比为________________(填最简整数比);
(4)新区实验初中的校医每天都用溶质质量分数为0.5%的过 氧乙酸溶液对教室等场所进行消毒。要配制这种溶液 600kg,需要溶质质量分数为 40%的过氧乙酸溶液____________kg。
(三)二氧化氯(ClO2)
资料:①ClO2是一种黄绿色、有刺激性气味的气体,熔点:﹣59.0℃,沸点:11.0℃,②冷却至11.0℃以下时变成红色液体,③易溶于水,④见光易分解,⑤易与碱反应,⑥杀菌、漂白能力均优 于 Cl2。消毒水体时不生成有害物质,也不存在用氯气消毒时残留的臭味。
(1)以上关于 ClO2 的描述中,属于化学性质的是________________(填序号);
(2)制取 ClO2 的方法有多种,目前欧洲一些国家用氯酸钠(NaClO3)与浓盐酸反应制取 ClO2(Kestiog 法),同时有 Cl2、NaCl 和一种常见的氧化物生成,该反应中涉及的氯元素的化合价有________种;
(3)我国最近研究成功用 Cl2 和 NaClO2(N2 保护下)制取 ClO2,同时有 NaCl 生成,该反应的化学方程式是_____________;此法与 Kestiog 法相比,其优点是_________; (写出其中的一条)
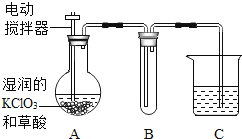
(4)工业上也可以在 60℃时,用稍加潮湿的 KClO3 与草酸(C2H2O4)反应制取 ClO2。某实验小组用如下图装置制取并收集 ClO2,A 为 ClO2 的发生装置,B 为 ClO2 的收集装置,C 为尾气吸收装置。
请问:为了保证实验成功,实验时,A 装置应浸在_____中加热; B 装置外加冰水冷却,试管内可观察到的现象是________;C 中所盛放的药品可以是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象反映的变化规律与其对应操作不相符的是
A. 向氯化钠的饱和溶液中加入氯化钾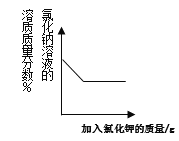
B. 向灼热的赤铁矿中通入CO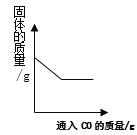
C. 向等质量的Al和Mg中加入足量的等质量等溶质质量分数的稀盐酸
D. 将饱和的氯化钠溶液恒温蒸发水
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是

A.该装置能将化学能转变为电能
B.反应实质是锌原子失去电子,氢离子得到电子,电子的定向移动形成电流
C.电子由铜片通过导线流向锌片
D.锌片为负极,且锌片逐渐溶解,铜片为正极,且铜片上有气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】图中字母代表含硫元素的物质,下列判断错误的是
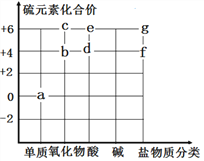
A. 物质d为H2SO3 ,读作亚硫酸
B. 物质b与氧气反应可生成物质C
C. 物质a在氧气中燃烧可以生成物质C
D. 物质Na2SO3、CaSO4可分别用f、g表示
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示溶解度曲线判断,下列说法正确的是( )
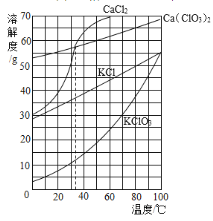
A. 20℃时,将10 g KClO3加入100 g水中,溶液质量为110 g
B. 30℃时,KCl饱和溶液中溶质的质量分数约为35%
C. 分别将35℃的CaCl2和Ca(ClO3)2两种饱和溶液升温至40℃,CaCl2溶液中溶质的质量分数较大
D. 除去CaCl2中混有的少量Ca(ClO3)2,可在较高温度配成饱和溶液,再降温结晶、过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状;再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状。则滴管甲、乙和烧杯①、②中的物质可能是

A.甲:水,①:食盐; 乙:水,②:蔗糖
B.甲:水,①:氢氧化钠; 乙:稀盐酸,②:镁
C.甲:水,①:硝酸铵; 乙:稀硫酸,②:锌
D.甲:水,①:生石灰; 乙:稀盐酸,②:氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文
碳元素是最早被人类认识和利用的元素。碳元素在地球上虽然广泛分布,但其含量不足0.03%。碳元素是一切有机体骨架的组成元素,在人体中的含量约占 18%。主要以有机含碳化合物形式存在,如糖类、蛋白质等。人体中的无机含碳化合物种类较少,在血浆中主要以碳酸氢盐缓冲系统 (H2CO3/HCO3-)的形式存在。迄今为止,发现了 15 种碳原子,它们在元素周期表中占据如图 1 所示的同一个“格”,其中 C-12 和C-13 属于稳定型,考古研究中,通过测定 C-14 含量估算古物的年代。20 世纪起,人类对碳元素的认识突飞猛进。下表列出了与之相关的主要事件:碳的这些新型结构的发现和性能研究的发展,使其广泛应用于工业、材料、生物医学等领域。依据文章内容回答下列问题:

时间 | 40 年代 | 1967 年 | 1969 年 | 1985 年 | 1991 年 | 21 世纪 |
事件 | 发现C-14 | 发现六角金刚 石和单斜超硬 碳 | 发现银白色的白炭 | 发现富勒烯 的第一个成 员 C60(图 2) | 发现碳纳米管(图 3) | 从石墨中剥离出仅 由一层碳原子构成 的薄片-石墨烯(图4) |
(1)碳在人体中的存在形式有_______ 种;
(2)关于图 1 所示的相关信息分析,错误的是________;
A 原子序数为 6 B 电子数为 12 C 元素符号为 C
(3)结合你所学的知识,你认为原子 C-12 和 C-13 的不同点是________;
A 质子数不同 B 电子数不同 C 中子数不同
(4)从石墨中剥离出来的石墨烯具有优良的各种性能,被认为是一种未来革命性的材料。石墨和金刚石的物理性质不同的原因是________;
(5)富勒烯 C60 中数字“60”的含义是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某CuSO4溶液中溶质的质量分数,取150g CuSO4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见下表。请计算:
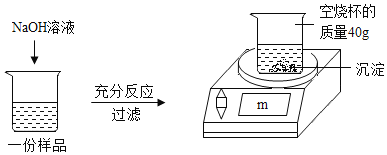
实验1 | 实验2 | 实验3 | |
样品质量/g | 50 | 50 | 50 |
NaOH溶液质量/g | 20 | 40 | 60 |
m/g | 42.45 | 44.9 | 44.9 |
(1)50g CuSO4溶液完全反应时,所得沉淀的质星为_____g。
(2)CuSO4溶液中溶质的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com