
科目: 来源: 题型:
【题目】请根据下列装置图回答问题。

(1)A中制取气体的化学方程式为_____,其验满的方法是_____。 A装置还可用于实验室制取氧气,反应的化学方程式为_____。
(2)实验B中,观察到蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组同学利用下图装置分别完成2个实验。
序号 | 甲 | 乙 | 分液漏斗 |
1 | 大理石 | 澄清石灰水 | 稀盐酸 |
2 | 二氧化锰 | 80℃热水及一小块白磷 | 过氧化氢溶液 |

(1)实验1:打开b和a,将分液漏斗中过量的盐酸注入,关闭a,此时乙中反应的化学方程式是_____,一段时间后,关闭b,观察到乙中液体变澄清,产生此现象的原因是_____。
(2)实验2:观察到乙中白磷的现象是_____;打开b和a,当分液漏斗中的过氧化氢溶液全部注入后,关闭a,观察到乙中白磷的现象是_____。关闭b,一段时间后,白磷的现象及原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列实验中的有关问题。
|
|
|
A | B | C |
(1)A中正极产生气体的检验方法是_____。
(2)B中通过比较①②塑料瓶变瘪的不同,可得出的结论是_____。
(3)C中可观察到的现象是_____,反应的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】历史上的丝绸之路主要是商品互通有无,今天的一带一路同样是合作与共赢。
| 输出 | 输入 |
凿井技术、冶金技术、铁器、丝绸、陶器、茶叶等 | 汗血马及动物皮货、葡萄、黄瓜、胡萝卜、蚕豆、珠宝首饰、药材、香料等 | |
| 管线、铁路、港口、机场、电信、核电等基础设备和能源设备及日常用品等 | 成品油和石化衍生品、天然气等 |
(1)古代冶金技术中湿法炼铜的反应原理是_____,现代铁路基建中需要大量的钢铁,工业用含80吨氧化铁的赤铁矿炼铁,理论上能得到铁_____吨。
(2)天然气主要成分是甲烷,在甲烷中碳元素与氢元素的质量比是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是人类生存的保障。自来水厂生产流程如下图所示,
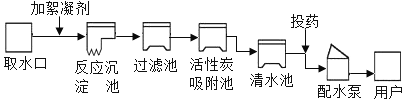
(1)自来水厂应用水净化的方法有_____。
A 过滤 B 吸附 C 消毒 D 蒸馏
(2)进入用户的自来水属于_____。
A 纯净物 B 混合物 C 氧化物
(3)下列节水措施可行的是_____。
A 用淘米水浇花 B 使用节水龙头
C 尽量少喝水 D 使用生活污水灌溉农田
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个图象中,能正确反映对应变化关系的是
|
|
|
|
A.向一定量铁粉中加入稀盐酸,测定生成氢气的质量 | B.向一定量碳酸钙固体中加入稀盐酸,测定生成气体的质量 | C.向一定量氧化铁固体中加入稀盐酸,测定溶液中铁元素的质量 | D.向一定量氢氧化钠溶液中加入稀盐酸,测定溶液中氢氧化钠的质量 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们通过学习知道铜与盐酸、稀硫酸不能发生反应,但却发现化学老师用铜与浓硝酸制备出了NO2气体去做物理实验。同学们对此很感兴趣,在实验室对铜与硝酸的反应进行了探究。
实验I | 实验II | ||
实验装置 | 实验现象 | 实验装置 | 实验现象 |
| 铜片逐渐消失, 有无色气泡产生,试管中上部有红棕色气体出现;溶液由无色变为蓝色 |
| 铜片逐渐消失, 产生红棕色气体,溶液由无色变为绿色 |
(探究一)实验I中产生的无色气体是什么?
(查阅资料)
(1)硝酸(HNO3)与Cu反应生成硝酸铜和含氮元素的化合物;硝酸铜溶液呈蓝色
(2)含氮元素的某些气态物质的物理性质
NH3 | NO | NO2 | |
颜色 | 无色 | 无色 | 红棕色 |
气味 | 刺激性 | 刺激性 | |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(3)NO2与水反应生成无色的硝酸和NO气体
(猜想与假设)无色气体可能是:①NH3 ②NO
(进行实验)同学们利用下图装置对产生的无色气体进行检验。
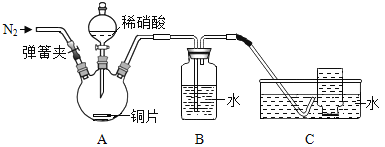
实验操作 | 实验现象 |
1. 打开弹簧夹,通入N2,一段时间后,关闭弹簧夹 | B、C中导管口有无色气泡冒出 |
2. 将C中导管伸入集气瓶中,打开分液漏斗的活塞,滴入一定量稀硝酸,关闭活塞 | A中有无色气泡产生 B中导管口有无色气泡冒出 C中集气瓶内收集到无色气体 |
3. 从水槽中取出集气瓶,敞口置于空气中 | 无色气体变为红棕色 |
4. 取少量B中液体于试管中,滴加无色酚酞溶液 | 试管中溶液颜色无明显变化 |
(解释与结论)
(1)操作1中,通入N2的目的是_____。
(2)同学们认为猜想①不正确,理由是_____。
(3)无色气体具有的化学性质是_____。
(探究二)为什么实验II中的溶液呈绿色而不是蓝色?
(猜想与假设)①溶液中硝酸铜的质量分数较高②硝酸铜溶液中溶解了生成的气体
(设计实验)同学们设计了以下4个实验方案。
方案1 | 配制饱和硝酸铜溶液并稀释至不同的浓度,观察溶液颜色变化 |
方案2 | 加水稀释实验II所得的绿色溶液,观察溶液颜色变化 |
方案3 | 取实验II所得的绿色溶液,加热,观察溶液颜色变化 |
方案4 | 配制饱和硝酸铜溶液,…… |
(反思与评价)
(1)“方案1”和“方案3”中,能验证猜想②的是_____。
(2)“方案2”不能验证猜想①的原因是_____。
(3)“方案4”也可验证猜想②,该方案是:配制饱和硝酸铜溶液,_____。
(4)通过实验I、II与已有知识的对比,可得出的结论是_____(答一条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌是一种常用的化学添加剂,广泛应用于药膏、阻燃剂等产品的生产中。由锌灰(主要成分是Zn)生产活性ZnO的部分生产流程如下:
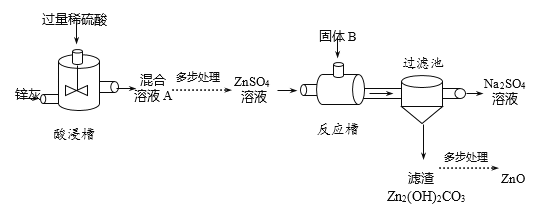
(1)酸浸槽中,Zn与稀硫酸反应的化学方程式为_____。
(2)混合溶液A中一定含有的溶质是_____。
(3)固体B的成分可能是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用表中装置进行下列实验。
实验装置 | 实验1 | 实验2 |
| ①甲的试管中放入少量MnO2,滴管中放入过氧化氢溶液,乙、丙中各放入一小块白磷,依次加入适量的80℃的水。白磷均不燃烧 ②打开K1、K2,将过氧化氢溶液滴入试管中,观察到乙中白磷不燃烧,丙中白磷燃烧 ③一段时间后,丙中导管内液面上升 | ①关闭K1,打开K2,甲的试管中充满CO2,滴管中放入浓NaOH溶液;乙试管中放入足量的铁粉,丙中放入约半试管的稀盐酸 ②将浓NaOH溶液滴入甲试管中,一段时间后,打开K1 |
(1)实验1:甲中发生反应的化学方程式为_____;对比乙和丙中的实验现象,说出本实验欲探究的燃烧条件是_____。
(2)实验1:步骤③的现象说明装置内压强减小,压强减小的原因是_____。
(3)实验2:甲中发生反应的化学方程式为_____;打开K1,乙中的现象是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室去除粗盐中难溶性杂质的过程如图所示。

(1)步骤①中使用玻璃棒的目的是_____。
(2)步骤②中过滤器的制作如图,正确的顺序是_____(填序号)。
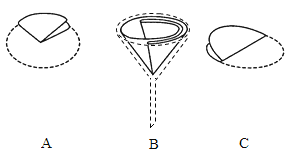
(3)步骤③的名称是_____。当观察到_____时,停止加热。
(4)在上述粗盐提纯的过程中,利用到氯化钠的物理性质有_____(答一条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com