
科目: 来源: 题型:
【题目】在实验室常用以下装置制取气。
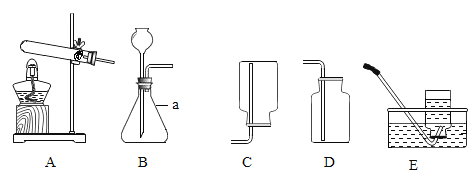
(1)装置图中仪器a的名称是__,用大理石和稀盐酸制取二氧化碳,反应的化学方程式为_______ ;最好选用_____ 装置(填字母序号,下同)所示的方法收集二氧化碳。
(2)用高锰酸钾制氧气,应选用的发生装置是__________;反应的化学方程式为_______;能用装置E收集氧气的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的学科,为了更精确地测定空气中氧气的体积分数,某小组设计了下图所示装置,其中注射器容积 50mL,试管中空气体积100mL红磷(P4)足量。(说明:导管中的空气忽略不计,夹持装置已省略,装置气密性良好)
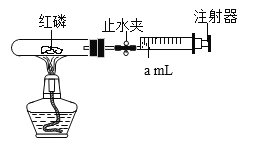
(1)实验前,注射器活塞在amL刻度处,a的最小合理值是___(填字母序号)。
A 18 B 20 C 22
(2)请从微观角度分析实验原理。____________
(3)使用该装置正确操作,可能仍会产生的安全问题是__________,某同学认为去掉止水夹可解决此问题且也能达成实验目的,你是否赞同,说明理由。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是甲、乙两种固体物质的溶解度曲线。
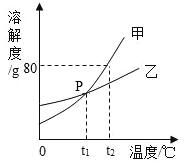
(1)P点的含义是_____。将乙的饱和溶液从t1℃升温至t2℃,溶液的质量分数_____(填“变大”、“不变”或“变小”)。
(2)t2℃时,将50g甲加入50g水中,充分搅拌,所得溶液的质量为_____g。将甲的饱和溶液变成不饱和的方法之一是__________。
(3)乙的饱和溶液中含有少量甲,可用______________方法提纯乙。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类的衣、食、住、行离不开材料和能源。
(1)地球上的金属资源,除少数不活泼的金属外,大部分是以_____形式存在。工业上用赤铁矿(主要成分是 Fe2O3)和一氧化碳炼铁的化学方程式为__________。
(2)汽油是石油分馏的产品之一,汽油中主要含有_____元素,在汽油中加入乙醇作为汽车燃料的主要目的是节约化石燃料和_____,以氢能源为动力的汽车能真正实现“零排放”但氢能源目前还不能广泛使用的原因之一是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,下图是元素周期表的部分内容及碳原子的结构示意图,完成相关问题。
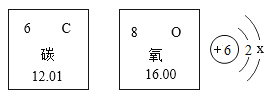
(1)碳元素的相对原子质量是_____;x的数值为_____。
(2)碳、氧两种元素的本质区别是_____不同,二者能组成一种产生温室效应的气体,其化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
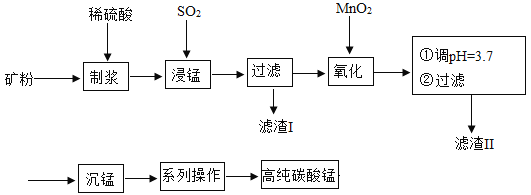
已知:①SiO2不溶于水,不与稀H2SO4、SO2反应;②MnO2能将Fe2+氧化成Fe3+;③溶液中的Fe3+在 pH 大于或等于 3.2 时将完全转化为Fe(OH)3沉淀。
请回答:(1)滤渣Ⅰ、Ⅱ分别为_____、_____(写化学式) ;
(2)浸锰过程中发生了 2 个化学反应,其中一个为Fe2O3与SO2反应,该反应的化学方 程式为Fe2O3+ SO2+H2SO4=2FeSO4+ H2O,另一个为MnO2和SO2按化学计量数为 1:1 发生化合反应,请写出该反应的化学方程式:_____, 该反应中共有_____种元素的化合价发生了改变。
(3)“沉锰”:加入NH4HCO3溶液后,生成了 4 种产物,其中含有MnCO3沉淀和某种气 体,写出该反应的化学方程式:_____。
(4)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓 溶液吸收,得到白色沉淀 19.7g,则所得产品的纯度为_____%(保留一位小数)
(5)某研究小组用稀H2SO4与菱锰矿(含有MnCO3)反应来浸出Mn2+,该研究小组选 定两个因素作为研究条件进行对比实验,数据如下:
矿酸比 | 温度/(℃) | 浸出率/(%) | |
1 | 1:0.5 | 60 | 80.2 |
2 | 1:0.5 | 80 | 83.8 |
3 | 1:0.6 | 60 | X |
4 | 1:0.6 | 80 | 91.8 |
表中 X 最有可能的数值为_____。
a.79.7 b.80.8 c.87.6 d.92.8
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室部分装置如图所示,请回答下列问题。
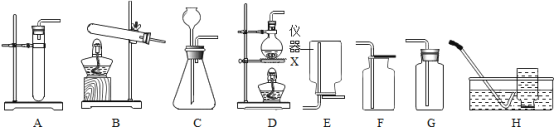
(1)仪器 X 的名称是_________。
(2)① 用大理石和稀盐酸制取CO2,该反应的化学方程式为_________,能作为该反应的发生装置的是_________(填字母,下同)。
②若使用过氧化氢溶液和二氧化锰制取O2,并在制取过程中便于补充过氧化氢溶液,发生装置应选择_________,收集装置应选择_____。
(3)实验室通过加热亚硝酸钠和氯化铵的混合溶液制取并收集 N2时,应选择_________ 与_________组合而成的装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
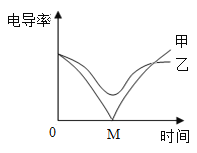
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氧化镍(化学式为:NiOOH)可用作镍氢电池的正极材料。工业上以某废液(主要溶质为:硫酸镍,其化学式为:NiSO4,另外还含有一些其他杂质。)为原料生产NiOOH 的步骤如下:
步骤 I:向废液中加入 Na2CO3 溶液生成沉淀,过滤,洗涤,得到固体 NiCO3。
步骤 II:向固体 NiCO3 中加入稀硫酸,固体溶解,得到硫酸镍溶液。
步骤 III:调节硫酸镍溶液的 pH,可将硫酸镍转化为氢氧化镍沉淀(化学式为:Ni(OH)2), 过滤并洗涤沉淀。
步骤 IV:将氢氧化镍沉淀置于空气中加热,生成碱式氧化镍(化学式为:NiOOH)。 请回答以下问题:
(1)NiOOH 中 Ni 的化合价为:_____。
(2)写出向废液中加入 Na2CO3 溶液生成 NiCO3 沉淀的化学方程式_____。
(3)步骤 I 和步骤 II 的作用是:_____。
(4)步骤 IV中生成了碱式氧化镍和水,请写出步骤 IV中发生反应的化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)增大压强, HCl由气态变为液态, 从微观的角度分析该变化过程中改变的是____。
(2)在盐酸中加入过量的铁粉充分反应。如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):
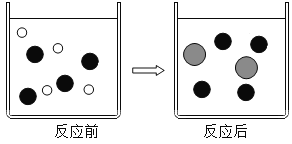
![]() _____、
_____、![]() ____、
____、![]() ____。
____。
(3)取 2 支试管,分别开展如下实验:
实验 I:在充满 HCl 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 II:在充满CO2气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 I 和实验 II 滴入水后的现象为:_______。
(4)向盛有Na2CO3粉末的试管中通入 HCl 气体,无明显现象;停止通气,再加入少量水,现象是___________,写出该反应的化学方程式_____。
(5)结合(3)与(4)中有关的实验与现象,下列有关 HCl 气体和盐酸中说法正确的是: _____
a.HCl 气体和盐酸具有完全相同的化学性质;
b.HCl 气体中含有氢离子;
c.向盛有CaCO3固体的试管中滴入稀盐酸,能放出使澄清石灰水变浑浊的气体;
d.HCl 气体和CO2气体通入水后均产生了氢离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com