
科目: 来源: 题型:
【题目】化学是一门自然科学,其特征是研究物质和创造物质。
(1)硅是太阳能电池和电脑芯片不可缺少的材料。人们利用石英砂(主要成分是二氧化硅)制得高纯硅。生产高纯硅的流程示意图如下:
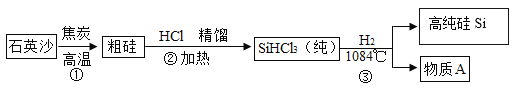
①制备粗硅的反应为: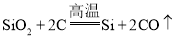 ,该反应属于___反应(选填“分解”“化合”“置换”“复分解”之一)。
,该反应属于___反应(选填“分解”“化合”“置换”“复分解”之一)。
②制备过程中用到H2,在点燃或加热H2前,应该先进行的安全操作是_____。
③物质A通常状况下为无色有刺激性气味的气体,溶于水形成一种常见的酸,写出步骤③中的化学反应方程式_______。
(2)海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。加强对海水资源的开发利用,是解决我国沿海和西部苦咸水地区淡水危机和资源短缺问题的重要措施,是实现国民经济可持续发展战略的重要保证。从海水中取得淡水的过程称为“海水淡化”。现在所用的海水淡化方法主要分为蒸馏法(热法)和膜法两大类。
如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中有些溶质离子不能通过淡化膜,从而得到淡水。
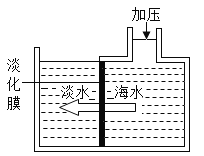
①将少量加压后的右侧海水置于表面皿中,用酒精灯加热,水分蒸干后,可在表面皿上观察到的现象是_______。
②下列对加压后右侧海水成分变化情况的分析中,正确的是___(填选项)。
A 溶质质量增加
B 溶剂质量减少
C 溶液质量不变
D 溶质质量分数减小
③氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4C1,NaHCO3结晶析出,再加热NaHCO3,制得纯碱。根据NaHCO3和NH4C1的溶解度曲线回答下列问题:
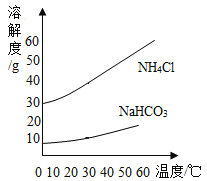
a.40℃时,NH4Cl饱和溶液的溶质质量分数_____NaHCO3饱和溶液的溶质质量分数(选填“大于”“小于”“等于”之一)。
b.把30℃时NH4Cl的饱和溶液升温到50℃后所得溶液是此温度下NH4Cl的溶液___(选填“饱和”或“不饱和”之一)
c.20℃时,将30 gNaHCO3固体置于100g水中,形成的溶液是此温度下NaHCO3的____溶液(选填“饱和”或“不饱和”之一)。
d.在50℃时将等质量的NaHCO3和NH4Cl饱和溶液同时降温到20℃,_____析出晶体质量较多(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】证据推理是科学研究的基本方法,已知某溶液A中的溶质可能含有Na2SO4和Na2CO3或两者之一,另有一种溶液B,其中的溶质可能是CuCl2和NH4Cl或两者之一。
按图示进行探究实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
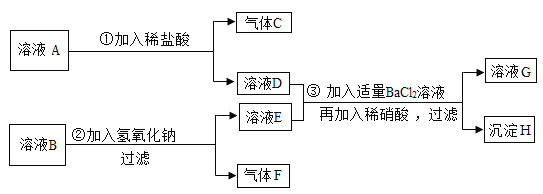
试根据实验过程和发生的现象,填写以下空白:
(1)气体C的化学式为_______,沉淀F的颜色为____。
(2)写出步骤①中发生反应的一个化学方程式___。
(3)取少量溶液G蒸发结晶,所得的固体为__(填写化学式)。
(4)由上述实验可分析出溶液A的组成为_____。
(5)由上述实验可分析出溶液B的组成为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属制品在日常生活、工农业生产和科学研究方面应用广泛。
(1)①铜质的器皿长期暴露在潮湿空气中会长出一层绿色的铜锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3)有人认为铜的锈蚀只是铜与水、氧气共同作用的结果,对于其组成,你认为还应补充的元素是_____(填元素符号),而空气中能大量提供这种元素的物质是____(填写化学式)。
②钢铁是应用最普遍的金属材料,请写出一条防止金属生锈的方法______。
(2)某小组的同学利用单质铜来进行实验,其设计步骤如下:
步骤一:称取6.4g铜粉在氧气中充分加热。
步骤二:将步骤一所得的固体与稀硫酸充分反应得到CuSO4蓝色溶液。
步骤三:向步骤二所得的CuSO4溶液中逐滴滴加10%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系曲线如图所示
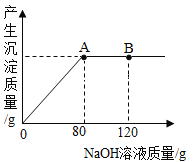
①步骤一中明显的现象是_____(写一条即可)。
②当滴入10%的氢氧化钠洛液80g时(即A点)时,恰好完全反应,此时参加反应的氢氧化钠溶质的质量为____g。
③试通过化学方程式计算求A点时所得Cu(OH)2沉淀的质量____(计算结果精确至0.1g)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示为实验室中常见的气体制备、干燥、净化、收集和性质实验的部分仪器,甲、乙两组同学欲用它们完成各自的探究实验。
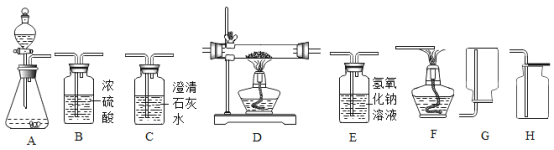
(1)甲组同学以过氧化氢溶液和二氧化锰为原料制取氧气,现欲制备并收集一瓶干燥的氧气,回答下列问题:
①所选仪器的连接顺序为_____。
②反应装置中生成氧气的化学方程式为______。
③过氧化氢溶液和二氧化锰混合后,随着反应的进行,二氧化锰的质量将____,过氧化氢溶液中溶质质量分数将_____(选填“增大”“减小”“不变”“无法判断”之一)。
(2)乙组同学用一氧化碳(含有少量水蒸气)来还原氧化铁和四氧化三铁的混合物,设计的仪器连接顺序为:混合气体→B→D→C→F(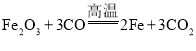 ;
;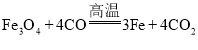 )
)
①装置B的作用是_______ ,装置F的作用是_________。
②写出C中的一项明显实验现象____。
③乙组同学按照上述的仪器连接顺序进行实验,充分反应后,测得装置D中固体的质量为ag,装置C中的质量增加bg,则反应前原固体混合物中铁元素和氧元素的质量比是____(计算结果用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化学用语是学习化学的重要工具。请按要求从氢气、一氧化碳、氢氧化钙、氢氧化钠、铜、硫酸中选择合适的物质,将其化学式填写在下列空格中。
①一种金属:_____。
②一种氧化物:_____。
③一种碱:_____。
④一种酸:_____。
(2)全国人民众志成城,共同抗击新冠状病毒。针对来势汹汹的病毒,我们应该运用所学知识进行防护。
①杀菌消毒,消灭新冠病毒。“84消毒液”是主要用于环境和物体表面消毒的含氯消毒剂,其主要有效成分为次氯酸钠(化学式为 NaClO),反应的方程式为:![]() ,次氯酸(HClO)具有极强的氧化性,能够将大多数物质氧化,使其变性。次氯酸(HClO)中C1元素的化合价为______。此消毒原理是利用了次氯酸的性质____(选填“物理”或“化学”之一)。
,次氯酸(HClO)具有极强的氧化性,能够将大多数物质氧化,使其变性。次氯酸(HClO)中C1元素的化合价为______。此消毒原理是利用了次氯酸的性质____(选填“物理”或“化学”之一)。

②自我隔离,切断传染路径。实践证明“延长假期,减少外出,在家隔离”是防止疫情扩散的最有效办法。开辟森林防火隔离带是为了防止森林火灾扩大、蔓延的有效措施之一。属于____(选填“物理”或“化学”之一)方法。

③做好防护,阻隔病毒入侵。抗击新冠状病毒期间,外出一定戴口罩,一次性外科口罩一般有三层防护,内层为纺粘无纺布,中层为熔喷布,外层为纺粘拒水层。熔喷布是口罩最核心的材料,熔喷布主要以聚丙烯(C3H6)n为主要原料。聚丙烯是由许多丙烯分子连在一起、聚合成大分子后得到的。聚丙烯(C3H6)n属于____(选填“有机高分子”“金属”“复合”之一)材料,在聚丙烯(C3H6)n分子中,碳、氢两元素原子个数之比为____(填写最简整数比),碳、氢两元素质量之比为____(填写最简整数比)。
查看答案和解析>>
科目: 来源: 题型:
【题目】烧杯中盛有一定质量的氧化镁和氧化铜的固体混合物,向其中加入7.3%的稀盐酸300g,恰好完全反应,得到该温度下的不饱和溶液316g。则下列相关计算中,正确的是
A.氧化镁和氧化铜的固体混合物质量为16g
B.混合物中氧元素质量为6.4g
C.最终所得溶液中含有溶质的质量为32.5g
D.最终所得溶液中含有氯元素的质量为21.3g
查看答案和解析>>
科目: 来源: 题型:
【题目】现有某纯净物X,将其配成无色溶液,取该溶液三等份,分别加入到足量的稀硫酸、澄清石灰水和氯化钠溶液中并振荡,产生的现象如下表。则有关该物质X的描述中正确的是
加入物质 | 稀硫酸 | 澄清石灰水 | 氯化钠溶液 |
实验现象 | 生成气体 | 生成沉淀 | 无明显现象 |
A.物质X中可能含有钾元素
B.物质X的溶液中可能含有SO![]()
C.物质X可能是碳酸钠
D.物质X一定是化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】当前,世界已经迈向了“低碳”时代,选择“低碳”既是一种生活方式也是一种生存责任。济南市公交系统适应形势发展,推广使用节能减排的双燃料公交车。下图为公交车燃料主要成分完全燃烧的化学反应的微观示意图。则下列说法中正确的是
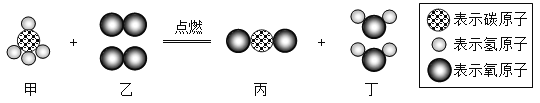
A.该反应中原子的种类数目都不改变
B.图示反应属于置换反应
C.甲、乙两物质参加反应的质量比为1:2
D.图示反应前后氧元素的化合价不变
查看答案和解析>>
科目: 来源: 题型:
【题目】化学家通过化学反应开发出了很多物质,推进了人类社会物质文明的进步。下列化学反应中,相关反应与反应类型标注均相符的是
A.电解法冶炼铝: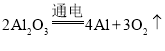 化合反应
化合反应
B.制备氢氧化钙:![]() 分解反应
分解反应
C.生产水煤气: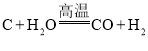 置换反应
置换反应
D.工业制烧碱:![]() 氧化反应
氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】取氯酸钾和二氧化锰的混合物26g,加热至固体质量不再减少为止,冷却后称得剩余固体质量为16.4g,将剩余固体加入一定量的足量的水中,充分搅拌后过滤得到10%的氯化钾溶液(假设溶液无损失),请计算:
(1)MnO2的相对分子质量=______。
(2)生成氧气的质量______。
(3)氯化钾溶液中水的质量_____(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com