
科目: 来源: 题型:
【题目】如图所示,A-G是初中化学常见的物质,其中B、C、D、E、F都是氧化物,图中“→”表示转化关系。“-”表示相互能反应,已知A是人体胃液中含有的酸,G是最轻的气体,B能作气体肥料,E是某些食品干燥剂的主要成分,D与A反应会生成黄色溶液,请回答:
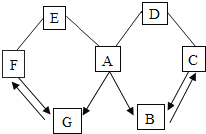
(1)F的化学式为______。
(2)E的俗名是______。
(3)C和D反应时的现象是______。
(4)A和D反应的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】白钨矿的主要成分是CaWO4,工业生产钨流程如下: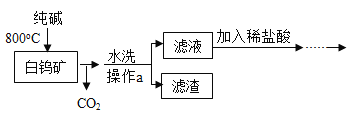
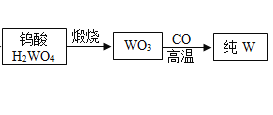
(1)水洗后,进行分离操作的名称是______,其中玻璃棒作用是______。
(2)白钨矿反应前需要进行粉碎,其目的是______。
(3)写出生成纯钨的化学方程式是______,写出金属钨的一种用途______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中①、②为氧元素、铝元素在元素周期表中的信息示意图,A、B、C、D是四种粒子的结构示意图。
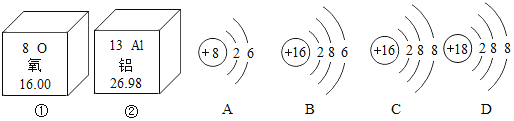
(1)氧元素的相对原子质量为______,C粒子属于______(填“原子”、“阴离子”或“阳离子”)。
(2)氧化铝中氧元素的化合价为-2价,则铝元素的化合价为______价。
(3)通常铝制品很耐腐蚀,原因是______(用化学方程式表示);铝还有特殊的性质,能溶解于氢氧化钠溶液中,反应的化学方程式2Al+2NaOH+2X═2NaAlO2+3H2↑,其中X的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】请从碳、氢、氧、氮、钙五种元素中选择适当的元素的元素符号和数字写出符合下列要求的式子:
(1)“骨质疏松症”的患者应补充的元素是______;
(2)2个碳酸根离子______;
(3)氧化钙中钙元素显+2价______。
的关键。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙固体的溶解度曲线。下列说法正确的是______
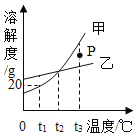
A 图中P点所表示的溶液是t3℃时甲的饱和溶液
B 可用t1℃时20%的甲溶液配制10%的甲溶液
C 若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D 分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,形成的溶液质量甲______(填“>”“<”或“=”)乙
查看答案和解析>>
科目: 来源: 题型:
【题目】小明在市场看到,鱼老板将一勺白色粉末加入水中,水中奄奄一息的鱼很快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探究.

【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为Na2CO4),常温下,与水反应生成氧气.【实验1】小明选用如图所示装置中的 (选填序号)进行过碳酸钠与水的反应并收集产生的气体,经检验该气体是氧气,检验方法是
【提出问题】过碳酸钠与水反应后得到的溶液M中溶质的成分是什么?
【作出猜想】根据过碳酸钠与水的组成作出三种猜想.
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH.
【实验2】小明取溶液M,滴加CaCl2溶液,观察到有白色沉淀生成,他认为白色沉淀是CaCO3,溶液中一定含有Na2CO3.小刚提出质疑,产生的白色沉淀不一定是CaCO3,他的理由是: .
【实验3】小刚取溶液M,滴加稀HCl,观察到 ,证明溶液中一定含有Na2CO3,从而否定了猜想二.Na2CO3与稀HCl反应的化学方程式为 .
【实验4】为进一步确定溶液M中是否含有NaOH,他们向溶质M中滴加CaCl2溶液至不再产生沉淀为止,取上层溶液,加入 ,无明显现象.证明溶液中无NaOH溶液,猜想一正确.该实验中用CaCl2溶液而不用饱和石灰水,原因是: .
【反思拓展】
(1)根据过碳酸钠的性质,保存时应注意防潮.
(2)检验A、B两种物质是否同时存在,一定要考虑二者性质的互相干扰问题.
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应的微观示意图如图,根据该图得出的结论,正确的是______

A 该反应属于置换反应
B 乙中元素的化合价反应前后不变
C 化学反应前后,原子种类、数目保持不变
D 生成的丙和丁的分子个数比为______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
A.加热氯酸钠和二氧化锰的混合物制氧气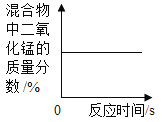
B.电解水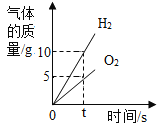
C.向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水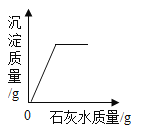
D.服用胃舒平(主要成分是Al(OH)3)治疗胃酸过多,胃液pH的变化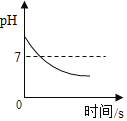
查看答案和解析>>
科目: 来源: 题型:
【题目】向100g氯化镁溶液中,不断加入一定溶质质量分数的氢氧化钾溶液,实验数据如下表:
氢氧化钾溶液的质量/g | 5.6 | 11.2 | 22.4 | 33.6 |
生成沉淀的质量/g | 0.145 | 0.29 | 0.58 | 0.58 |
(1)当滴加氢氧化钾溶液的质量为33.6g时,所得溶液的pH_____(填“<”“=”或“>”)7。
(2)选择合理的数据,计算该氯化镁溶液中溶质的质量分数_____。
(3)计算所用的氢氧化钾溶液中溶质的质量分数_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工厂产生的废液中含有硫酸铜、硫酸亚铁、硫酸锌、硫酸。为节能减排,回收硫酸锌及有关金属,设计如图部分流程。


(1)固体A的成分是_____;步骤Ⅱ中滤液C中所含的溶质有_____。
(2)写出步骤Ⅱ中生成气体的化学方程式_____,生成铁的化学方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com