
【题目】水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3、Pb(OH)42,各形态的浓度分数(α)随pH变化的关系如下图所示:
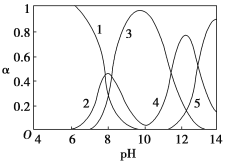
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3,5表示Pb(OH)42]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,![]() 增大,可能的原因是________________________________。
增大,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有______________,由pH=8到pH=9时主要反应的离子方程式为___________________________________。
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表;
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl |
处理前浓度/mg/L | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
处理后浓度/mg/L | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是____________________________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
A.3~4 B.6~7 C.8~9 D.10~12
【答案】(1)> Pb2+与Cl反应,Pb2+浓度减小
(2)Pb2+、Pb(OH)+、H+ Pb(OH)++OH![]() Pb(OH)2
Pb(OH)2
(3)Fe3+ (4)B
【解析】(1)由表中数据知溶液中的Pb2+会发生水解,故![]() >2;加入NH4Cl溶液后,pH减小,由图中可看出c(Pb2+)应增大,但题中说明
>2;加入NH4Cl溶液后,pH减小,由图中可看出c(Pb2+)应增大,但题中说明![]() 变大,只可能是Cl与Pb2+发生了反应。该反应实际为Pb2++2Cl
变大,只可能是Cl与Pb2+发生了反应。该反应实际为Pb2++2Cl![]() PbCl2。(2)由图中数据,知pH=8时,Pb的存在形式有Pb2+、Pb(OH)+和Pb(OH)2,其中Pb2+、Pb(OH)+为阳离子,又溶液中必有H+。而由表中数据,pH=8时,溶液中Pb的主要存在形式为Pb(OH)+,而pH=9时,溶液中Pb的主要存在形式为Pb(OH)2,因此,pH由8到9时,发生的主要反应为Pb(OH)++OH
PbCl2。(2)由图中数据,知pH=8时,Pb的存在形式有Pb2+、Pb(OH)+和Pb(OH)2,其中Pb2+、Pb(OH)+为阳离子,又溶液中必有H+。而由表中数据,pH=8时,溶液中Pb的主要存在形式为Pb(OH)+,而pH=9时,溶液中Pb的主要存在形式为Pb(OH)2,因此,pH由8到9时,发生的主要反应为Pb(OH)++OH![]() Pb(OH)2。(3)依照去除的百分率,可看出去除Fe3+的效果最好(不必精确计算,估算即可)。(4)要使Pb以Pb2+形式存在,需要保持较低的pH,而又由于脱除反应生成H+,pH太小会使反应难于正向进行,因此,因在保证Pb2+的浓度的条件下,选择尽量高的pH,结合图表,pH应在6~7之间。
Pb(OH)2。(3)依照去除的百分率,可看出去除Fe3+的效果最好(不必精确计算,估算即可)。(4)要使Pb以Pb2+形式存在,需要保持较低的pH,而又由于脱除反应生成H+,pH太小会使反应难于正向进行,因此,因在保证Pb2+的浓度的条件下,选择尽量高的pH,结合图表,pH应在6~7之间。


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中地理 来源: 题型:
【题目】(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:![]() +4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
+4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
①写出并配平该氧化还原反应的化学方程式:______________________。
②上述反应中被还原的元素是________,还原剂是________。
③反应生成0.3 mol H2O,则转移电子的数目为________mol。
(2)请配平下面化学方程式。
____CH3CH2OH+____KMnO4―→____CH3CHO+____MnO2+____KOH+____H2O。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
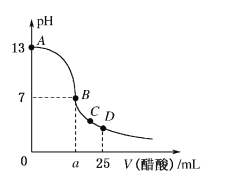
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】1.为探究从镀银车间的废液中回收银的效果,某化学兴趣小组的同学在25 ℃时进行了下列分析:
(1)他们取了35 L Ag+浓度为6×103 mol·L1的某镀银车间回收液,然后加入0.012 mol·L1NaCl溶液25 L,此时 (填“能”或“不能”)观察到AgCl沉淀。
(2)最后该溶液中的c(Ag+)为 ,生成AgCl的质量为 。
(3)AgCl在上述溶液中的溶解度与在纯水中的相比, 中的溶解度较大。
[已知Ksp(AgCl)=1.8×1010]
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如图所示:
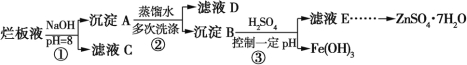
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成偏锌酸钠。Zn(OH)2溶解的离子方程式为 。
(3)滤液D中除了含有OH外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2 mol·L1,c(Fe3+)=2.6×109mol·L1,能求得的溶度积是 。
A.Ksp [Zn(OH)2] B.Ksp [Zn(OH)2]和Ksp [Fe(OH)3] C.Ksp [Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是 。
(6)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
②H2O(l)![]() H+(aq)+OH(aq) ΔH=b kJ·mol1
H+(aq)+OH(aq) ΔH=b kJ·mol1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K= (用含Ksp、Kw的代数式表示)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】据图回答下列问题:

(1)若某人长期营养不良,血浆中蛋白质含量降低,会引起如图所示中哪一部分的液体增多? [ ]_______,其结果将会引起_________。
(2)目前普遍认为,____________是维持内环境稳态的主要调节机制。
(3)若某人患镰刀型细胞贫血症,则形态发生变化的是图中[ ] ,引起这种变化的根本原因是____________;直接原因是该细胞中____________结构异常,使其与______结合能力下降;因此该病主要是影响人体有氧呼吸第______阶段。
人体组织细胞中的一个CO2分子从产生处扩散到空气中至少需要通过_______层生物膜。
(4)若图示为肝脏的内环境,肝炎病人化验时,需制取相当于图中[ ]的液体,会发现转氨酶的含量偏高,这是因为肝炎病人肝细胞膜的通透性______。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:
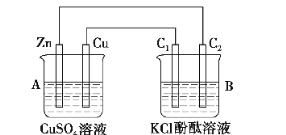
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为__________极,电极反应式为____________________________________________;
铜极为__________极,电极反应式为_____________________________________________;
石墨棒C1为__极,电极反应式为________;石墨棒C2附近发生的实验现象为
________________________________________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)________g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知硅及其化合物之间存在如图转化关系。其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体;某些C可作干燥剂或催化剂的载体;D是一种黏合剂,能将磨砂玻璃黏合在一起,E是一种比H2CO3酸性还弱的酸。
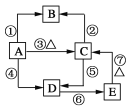
试回答下列问题:
(1)写出A、C、E的化学式:A________、C________、E________。
(2)①~⑦反应中,属于氧化还原反应的是________,属于置换反应的是______,属于离子反应的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com