
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
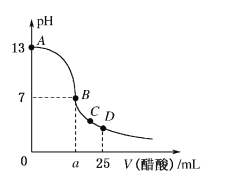
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中地理 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
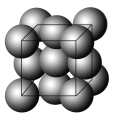
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016北京]在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
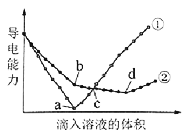
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3、Pb(OH)42,各形态的浓度分数(α)随pH变化的关系如下图所示:
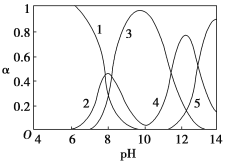
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3,5表示Pb(OH)42]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,![]() 增大,可能的原因是________________________________。
增大,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有______________,由pH=8到pH=9时主要反应的离子方程式为___________________________________。
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表;
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl |
处理前浓度/mg/L | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
处理后浓度/mg/L | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是____________________________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
A.3~4 B.6~7 C.8~9 D.10~12
查看答案和解析>>
科目:高中地理 来源: 题型:
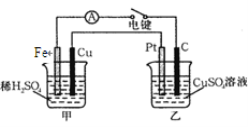
【题目】原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________。
(2)下列反应能设计成原电池的是: 。
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)下图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。
查看答案和解析>>
科目:高中地理 来源: 题型:
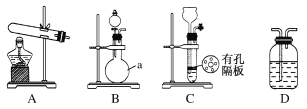
【题目】甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO![]() N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:________。
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、 硫酸、硫酸铵 | 反应的化学方程式为①____________________ |
乙小组 | ②______ | 浓氨水、氢氧化钠 | 氢氧化钠溶于氨水后放热,增加氢氧根离子浓度,加快氨气逸出 |
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为________。
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com