
【题目】听下面一段对话,完成五道小题,每小题仅填写一个词。这段对话你将听两遍。

【答案】
(1) welcome speech
(2) 9:30
(3) second
(4) science labs
(5) workshops
【解析】听力原文:
Welcome to Mountford school. Thank you for choosing our school and for joining the happy Mountford family which has been educating boys since 1916. We are so happy that you've taken time off to be with us today. It is with great pleasure that we have prepared some events that we hope will please you. At 9:00 a.m., our headmaster will give a welcome speech. This will be in the school hall. Please be seated by 8:45 a.m.. Following the speech is the guided tour of the exhibition at 9:30. Here, you can see the proud history of our school, and our achievements in the field of education. The exhibition is laid out in the classrooms on the second floor. Then the guided tour of science labs at 10:20 a.m., here you can see the subjects that new students will be studying. You will also notice that our labs have excellent equipment. At 11:00 a.m., you will be taken on the tour to practical areas. This covers our technical workshops, music and other areas of our school life. At Mountford, we believe in all round development of our students. Lunch will be at 12:00. It has been specially prepared for our guests. All our teachers and student leaders will be present to answer any questions that you have in your minds. We are so happy that you could be with us today.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中地理 来源: 题型:
【题目】已知:CO2+Ca(OH)2![]() CaCO3↓+H2O,CaCO3+CO2+H2O
CaCO3↓+H2O,CaCO3+CO2+H2O![]() Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
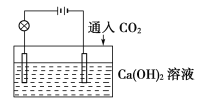
(1)通入CO2前,灯泡________(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度________。
(3)继续通入过量的CO2,灯泡的亮度________。
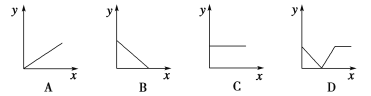
(4)下列四个图中,________(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ; 若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是(填图像符号) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前,c(HCl) c(NH3H2O)(填“大于”“小于”或“等于”,下同);混合前,酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016天津节选]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:![]() +4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
+4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
①写出并配平该氧化还原反应的化学方程式:______________________。
②上述反应中被还原的元素是________,还原剂是________。
③反应生成0.3 mol H2O,则转移电子的数目为________mol。
(2)请配平下面化学方程式。
____CH3CH2OH+____KMnO4―→____CH3CHO+____MnO2+____KOH+____H2O。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O===2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
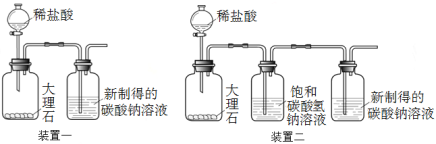
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ②利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 ②利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
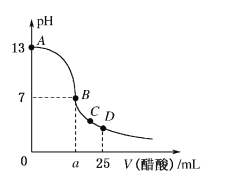
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如图所示:
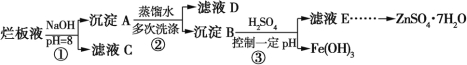
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成偏锌酸钠。Zn(OH)2溶解的离子方程式为 。
(3)滤液D中除了含有OH外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2 mol·L1,c(Fe3+)=2.6×109mol·L1,能求得的溶度积是 。
A.Ksp [Zn(OH)2] B.Ksp [Zn(OH)2]和Ksp [Fe(OH)3] C.Ksp [Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是 。
(6)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
②H2O(l)![]() H+(aq)+OH(aq) ΔH=b kJ·mol1
H+(aq)+OH(aq) ΔH=b kJ·mol1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K= (用含Ksp、Kw的代数式表示)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】 However hard I tried, I just couldn’t ______them of the truth of my story.
A. remind B. convince C. rid D. inform
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com