
【题目】已知某溶液中只存在OH-、H+、![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ; 若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是(填图像符号) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前,c(HCl) c(NH3H2O)(填“大于”“小于”或“等于”,下同);混合前,酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
【答案】(1)NH4Cl ①
(2)NH4Cl和NH3H2O NH4Cl和HCl
(3)B (4)小于 大于
【解析】由溶液中离子的电荷守恒可知:题设中的②是错误的。又由题中的离子只有四种,可得这样的溶液共有三种:NH4Cl 、NH4Cl和NH3H2O、NH4Cl和HCl。
(1)若溶液中只溶解一种溶质,则该溶质是NH4Cl,四种离子浓度的大小顺序为c(Cl)>c(![]() )>c(H+)>c(OH),选①。
)>c(H+)>c(OH),选①。
(2)若四种离子的关系符合③,溶液显碱性,则溶质为NH4Cl和NH3H2O;若四种离子的关系符合④,溶液显酸性,则溶质为NH4Cl和HCl。
(3)两种溶液稀释前后pH都小于7,稀释后pH均变大,因为NH4Cl溶液存在水解,更多的![]() 会发生水解,pH变化小于HCl溶液的。
会发生水解,pH变化小于HCl溶液的。
(4)因单一的NH4Cl 溶液呈酸性,当盐酸和氨水混合呈中性时,则NH3H2O过量,又因体积相等,故混合前,酸中c(HCl)小于c(NH3H2O),酸中c(H+)大于碱中c(OH-)。


 考前必练系列答案
考前必练系列答案科目:高中地理 来源: 题型:
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B混合产生无色气体;B+C混合产生白色沉淀;A+D产生白色沉淀;A+C混合无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):A________,B________,C________,D________。
(2)A+B反应的离子方程式为__________________________________。
(3)A+D反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
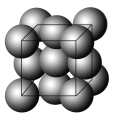
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某班学生通过分组实验测定酸碱滴定曲线。
实验用品:0.1 mol·L1 HCl溶液、0.1 mol·L1NaOH溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶。甲、乙、丙三组同学锥形瓶中的溶液所取酸溶液体积均为20.00 mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,其中乙和丙两组同学的操作上都存在着不足或失误。
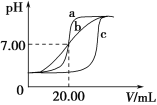
请回答下列问题:
(1)实验前pH计应用标准溶液进行校准,若将pH计放入c(H+)=0.000 1 mol·L1的标准溶液中校准,则pH计的读数应为________。
(2)甲组同学滴定时选用的滴定管为________(填“酸式”或“碱式”)滴定管,最后一次润洗滴定管应选用实验用品中的________进行润洗。
(3)乙组同学操作上的不足之处是_____________________________________。
(4)造成丙组同学的曲线与甲组同学不同的原因可能是________。(填字母编号)
A.用待装液润洗锥形瓶
B.滴定使用的滴定管的尖嘴部分在滴定前有气泡未排出,滴定后气泡消失
C.滴定前后对滴定管进行读数的视线分别如图所示

查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列 (填序号)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。
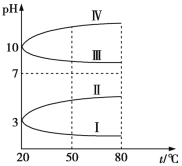
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
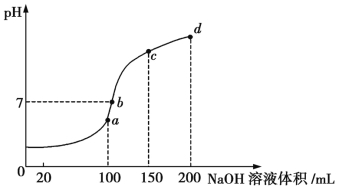
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
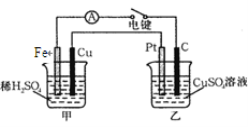
【题目】原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________。
(2)下列反应能设计成原电池的是: 。
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)下图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com