
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。
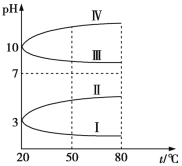
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
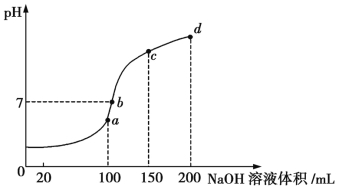
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
【答案】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水
(2)小于
(3)①Ⅰ NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小 ②10-3 mol/L
(4)a点 c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
【解析】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3吸附水中的悬浮颗粒使其沉降。
Al(OH)3(胶体)+3H+,Al(OH)3吸附水中的悬浮颗粒使其沉降。
(2)NH4Al(SO4)2溶液与NH4HSO4溶液中的![]() 均发生水解,但NH4Al(SO4)2溶液中Al3+水解后溶液呈酸性抑制
均发生水解,但NH4Al(SO4)2溶液中Al3+水解后溶液呈酸性抑制![]() 的水解,NH4HSO4溶液中
的水解,NH4HSO4溶液中![]() 电离出的H+同样抑制
电离出的H+同样抑制![]() 的水解,相同条件下,因为
的水解,相同条件下,因为![]() 电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4溶液中
电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4溶液中![]() 的水解程度比NH4Al(SO4)2溶液中
的水解程度比NH4Al(SO4)2溶液中![]() 的小。
的小。
(3)NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小,符合其变化的曲线为Ⅰ。根据电荷守恒,可以得出2c(![]() )-c(
)-c(![]() )-3c(Al3+)=c(H+)-c(OH-)=10-3 mol/L[其中c(OH-)太小,可忽略]。
)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol/L[其中c(OH-)太小,可忽略]。
(4)分析a、b、c、d四个点,根据反应物的用量可知,a点恰好消耗完![]() 电离出来的H+,溶液中的溶质为(NH4)2SO4与Na2SO4;b、c、d三点溶液中均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,故a点水的电离程度最大。b点溶液呈中性,即溶液中含有(NH4)2SO4、Na2SO4、NH3·H2O三种溶质,a点时c(Na+)=c(
电离出来的H+,溶液中的溶质为(NH4)2SO4与Na2SO4;b、c、d三点溶液中均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,故a点水的电离程度最大。b点溶液呈中性,即溶液中含有(NH4)2SO4、Na2SO4、NH3·H2O三种溶质,a点时c(Na+)=c(![]() ),则b点时c(Na+)>c
),则b点时c(Na+)>c![]() ),根据电荷守恒可得b点时c(
),根据电荷守恒可得b点时c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() ),故可以得出c(
),故可以得出c(![]() )>c(
)>c(![]() ),故b点时c(Na+)>c
),故b点时c(Na+)>c![]() )>c(
)>c(![]() )>c(OH-)=c(H+)。
)>c(OH-)=c(H+)。


科目:高中地理 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:__________________________________________________________________;
H2SO4:________________________________________________________________;
Ca(OH)2:______________________________________________________________;
KOH:________________________________________________________________;
NH4NO3:_____________________________________________________________;
KAl(SO4)2:____________________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如,帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。这说明维生素C具有________(填“氧化性”或“还原性”)。
(2)2Na+O2![]() Na2O2反应中,
Na2O2反应中,
①________被氧化,________是氧化剂,氧化产物是_______,过氧化钠中氧元素的化合价是_______。
②此反应中若转移了2 mol的电子,则需要氧气________ mol。
③用单线桥或双线桥法表示反应中电子转移的方向和数目:___________________________________。
(3)根据反应①2FeCl3+2KI![]() 2FeCl2+2KCl+I2,②2FeCl2+Cl2
2FeCl2+2KCl+I2,②2FeCl2+Cl2![]() 2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017江苏]砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是___________________________________。
,其原因是___________________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
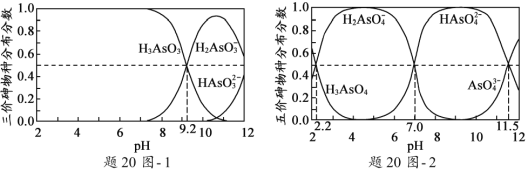
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_____________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4+H+的电离常数为Ka1,则pKa1=_________(pKa1=lgKa1)。
H2AsO4+H+的电离常数为Ka1,则pKa1=_________(pKa1=lgKa1)。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时,吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图3所示。
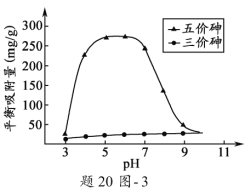
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ; 若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是(填图像符号) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前,c(HCl) c(NH3H2O)(填“大于”“小于”或“等于”,下同);混合前,酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
(2)写出表示管道煤气中的一氧化碳燃烧热的热化学方程式_________________________。
(3)充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、________等。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016天津节选]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O===2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
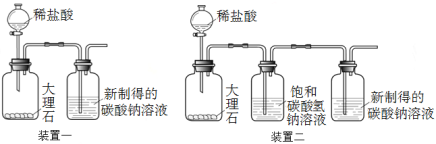
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ②利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 ②利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
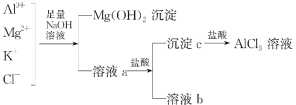
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_______________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)溶液a中存在的离子有________________;在溶液a中加入盐酸时需控制盐酸的量,为什么?__________________________________。为此,改进方法是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com