
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
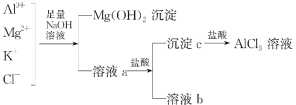
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_______________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)溶液a中存在的离子有________________;在溶液a中加入盐酸时需控制盐酸的量,为什么?__________________________________。为此,改进方法是___________________________。
【答案】(1)Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===![]() +2H2O
+2H2O
(2)不能,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Na+、![]() 、K+、Cl、H+、OH 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀
、K+、Cl、H+、OH 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀![]() 时,需要控制溶液的pH,以防止部分
时,需要控制溶液的pH,以防止部分![]() 转化成Al3+ 通入过量CO2气体
转化成Al3+ 通入过量CO2气体
【解析】解答本题的关键是明确Mg2+、Al3+均能与NaOH溶液反应生成沉淀,而Mg(OH)2不能继续溶解,Al(OH)3能溶解在过量的NaOH溶液中。不能用氨水代替NaOH溶液,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中地理 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。
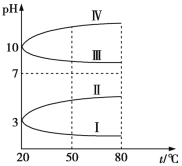
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
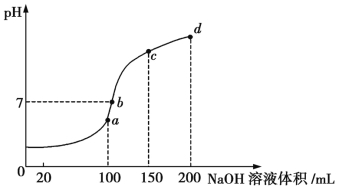
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某化学课外小组欲制取纯净的Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
A.大理石 B.盐酸
C.氢氧化钠溶液 D.澄清石灰水
三名同学设计的制备实验方案的反应流程分别如下:
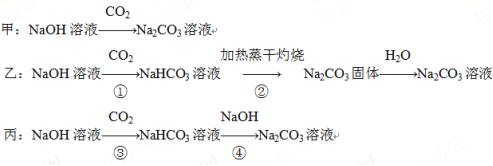
请回答下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案:______________________________________________________。
乙方案:______________________________________________________。
(2)假设反应③所得的NaHCO3溶液中含有Na2CO3,现要用A~D四种试剂证明Na2CO3的存在,你所选择的试剂有________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________。
(2)下列反应能设计成原电池的是: 。
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)下图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。
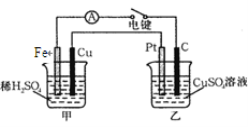
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与加入的NaOH的物质的量之间的关系曲线。
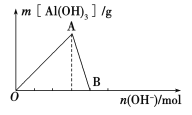
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
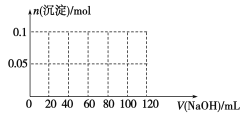
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)实验室制取Cl2时,下列操作不正确的是________(填序号)。

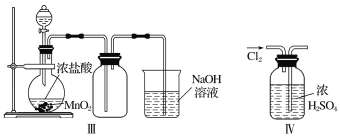
①装置Ⅰ可用于制取少量Cl2
②用装置Ⅱ除去Cl2中的少量HCl
③用装置Ⅲ制取Cl2
④用装置Ⅳ干燥Cl2
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有__________、__________、__________。
(3)已知KMnO4与浓盐酸在常温下反应能产生Cl2。
若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母,下同)。
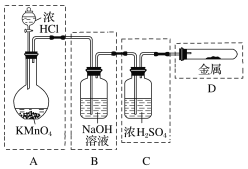
(4)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的装置正确的是________。
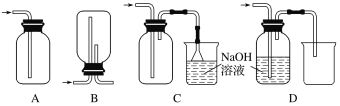
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
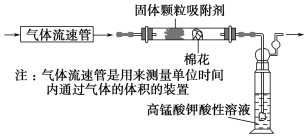
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
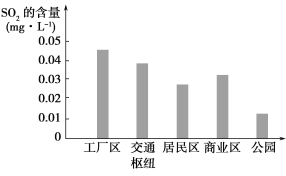
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
①_____________________________________________________;
②_____________________________________________________。
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(2017·江苏改编) Indeed ___________(官方的) figures suggest the country has shrunk by 5% since 1993 and people in Russia live a shorter life now than those in 1961.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com