
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
【答案】(1)S(AgX)>S(AgY)>S(AgZ) (2)减小 (3)1.0×106mol·L1
(4)①能,Ksp(AgY)=1.0×1012>Ksp(AgZ)=8.7×1017
②当溶液中c(X)≥1.8×104mol·L1时,AgY开始向AgX转化
【解析】(1)对同类型的难溶电解质,在相同温度下,Ksp越大,溶解度就越大;Ksp越小,溶解度就越小。则S(AgX)>S(AgY)>S(AgZ)。
(2)向AgY的饱和溶液中加入少量的AgX固体,S(AgX)>S(AgY),AgX的溶解度大于AgY,溶液中的c(Ag+)增大,AgY的溶解平衡向着形成沉淀的方向移动,c(Y)减小。
(3)AgY饱和溶液中,c(Ag+)=![]() =
=![]() =1.0×106(mol·L1),假设AgY固体完全溶解,c(Ag+)=1.0×102mol·L1,故0.188 g AgY不能完全溶解,其溶液中c(Y)=1.0×106mol·L1。
=1.0×106(mol·L1),假设AgY固体完全溶解,c(Ag+)=1.0×102mol·L1,故0.188 g AgY不能完全溶解,其溶液中c(Y)=1.0×106mol·L1。
(4)①Ksp(AgY)=1.0×1012>Ksp(AgZ)=8.7×1017,故能转化。②当溶液中c(X)>![]() mol·L1=1.8×104 mol·L1时,AgY开始向AgX转化。
mol·L1=1.8×104 mol·L1时,AgY开始向AgX转化。


科目:高中地理 来源: 题型:
【题目】(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如,帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。这说明维生素C具有________(填“氧化性”或“还原性”)。
(2)2Na+O2![]() Na2O2反应中,
Na2O2反应中,
①________被氧化,________是氧化剂,氧化产物是_______,过氧化钠中氧元素的化合价是_______。
②此反应中若转移了2 mol的电子,则需要氧气________ mol。
③用单线桥或双线桥法表示反应中电子转移的方向和数目:___________________________________。
(3)根据反应①2FeCl3+2KI![]() 2FeCl2+2KCl+I2,②2FeCl2+Cl2
2FeCl2+2KCl+I2,②2FeCl2+Cl2![]() 2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016天津节选]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O===2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
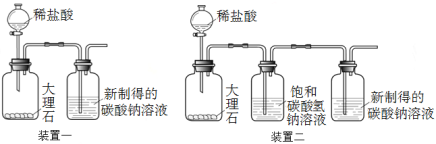
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ②利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 ②利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
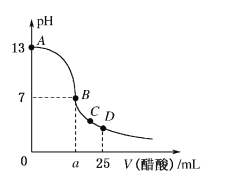
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】阅读材料,回答下列问题。
材料:近年来,科技人员研究得到一种新型材料——泡沫铝,它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是________。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔作食品包装,是利用它的哪一性质________。
A.金属光泽 B.延展性
C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:
与盐酸反应的离子方程式:__________________________________________。
与氢氧化钠溶液反应的离子方程式:__________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如图所示:
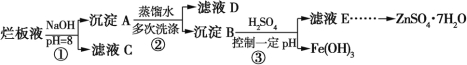
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成偏锌酸钠。Zn(OH)2溶解的离子方程式为 。
(3)滤液D中除了含有OH外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2 mol·L1,c(Fe3+)=2.6×109mol·L1,能求得的溶度积是 。
A.Ksp [Zn(OH)2] B.Ksp [Zn(OH)2]和Ksp [Fe(OH)3] C.Ksp [Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是 。
(6)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
②H2O(l)![]() H+(aq)+OH(aq) ΔH=b kJ·mol1
H+(aq)+OH(aq) ΔH=b kJ·mol1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K= (用含Ksp、Kw的代数式表示)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
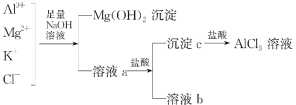
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_______________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)溶液a中存在的离子有________________;在溶液a中加入盐酸时需控制盐酸的量,为什么?__________________________________。为此,改进方法是___________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(2017·天津)Mr. and Mrs. Brown would like to see their daughter ___________, get married, and have kids.
A. settle down B. keep off C. get up D. cut in
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com