
【题目】[2016天津节选]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
【答案】(1)污染小 可再生 来源广 资源丰富 燃烧热值高(任写其中2个)
H2+2OH--2e-=2H2O
(2)光能转化为化学能
(3)①阳极室
②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢
N点:c(OH-)过高,铁电极上有Fe(OH)3(或Fe2O3)生成,使Na2FeO4产率降低。
【解析】(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,故答案为:污染小;可再生;来源广;资源丰富;燃烧热值高;H2+2OH--2e-=2H2O
(2)利用太阳能直接分解水制氢,是将光能转化为化学能,故答案为:光能转化为化学能;
(3)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极作阳极,发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH)降低的区域在阳极室,故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,故答案为:防止Na2FeO4与H2反应使产率降低。
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢,或N点:c(OH-)过高,铁电极上有Fe(OH)3(或Fe2O3)生成,使Na2FeO4产率降低。


科目:高中地理 来源: 题型:
【题目】某班学生通过分组实验测定酸碱滴定曲线。
实验用品:0.1 mol·L1 HCl溶液、0.1 mol·L1NaOH溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶。甲、乙、丙三组同学锥形瓶中的溶液所取酸溶液体积均为20.00 mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,其中乙和丙两组同学的操作上都存在着不足或失误。
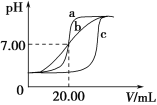
请回答下列问题:
(1)实验前pH计应用标准溶液进行校准,若将pH计放入c(H+)=0.000 1 mol·L1的标准溶液中校准,则pH计的读数应为________。
(2)甲组同学滴定时选用的滴定管为________(填“酸式”或“碱式”)滴定管,最后一次润洗滴定管应选用实验用品中的________进行润洗。
(3)乙组同学操作上的不足之处是_____________________________________。
(4)造成丙组同学的曲线与甲组同学不同的原因可能是________。(填字母编号)
A.用待装液润洗锥形瓶
B.滴定使用的滴定管的尖嘴部分在滴定前有气泡未排出,滴定后气泡消失
C.滴定前后对滴定管进行读数的视线分别如图所示

查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。
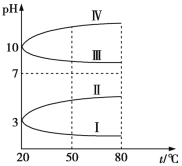
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
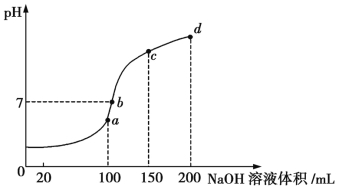
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:
NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度 (填“增大”“减小”或“不变”,下同),![]() 的浓度 。
的浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,此时溶液中浓度减小的粒子有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)实验室制取Cl2时,下列操作不正确的是________(填序号)。

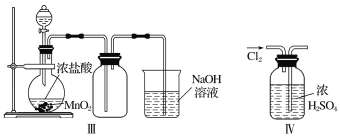
①装置Ⅰ可用于制取少量Cl2
②用装置Ⅱ除去Cl2中的少量HCl
③用装置Ⅲ制取Cl2
④用装置Ⅳ干燥Cl2
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有__________、__________、__________。
(3)已知KMnO4与浓盐酸在常温下反应能产生Cl2。
若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母,下同)。
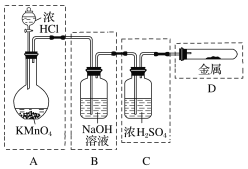
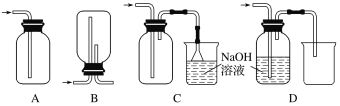
(4)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的装置正确的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com