
【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。
【答案】(1)研究反应物I-与![]() 的浓度对反应速率的影响(2分)
的浓度对反应速率的影响(2分)
(2)29.3(3分) (3)A(2分)
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比) (3分)
【解析】(1)由题目中表格数据可分析出c(I-)、c(![]() )浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与
)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与![]() 的浓度对反应速率的影响。
的浓度对反应速率的影响。
(2)因反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比),由①⑤中数据可列关系:显色时间t2=0.040×0.040×88.0/0.120×0.040=29.3 s。
(3)升高温度,反应速率加快,故显色时间t2<22.0 s。


 名校课堂系列答案
名校课堂系列答案科目:高中地理 来源: 题型:
【题目】按要求回答下列问题:
(1)聚苯乙烯的结构简式为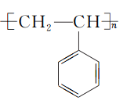 ,则
,则
①聚苯乙烯的链节是________,单体是______________。
②实验测得某聚苯乙烯的相对分子质量(平均值)为52 000,则该高聚物的聚合度n为________。
(2)写出下列反应的化学方程式,并指出反应类型。
①由乙烯制取聚乙烯:_______________________,________________。
②由丙烯制取聚丙烯:____________________,________________。
③由对苯二甲酸(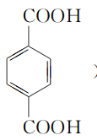 )与乙二醇发生反应生成高分子化合物:_____________,____________。
)与乙二醇发生反应生成高分子化合物:_____________,____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ; 若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是(填图像符号) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前,c(HCl) c(NH3H2O)(填“大于”“小于”或“等于”,下同);混合前,酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016天津节选]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:![]() +4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
+4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
①写出并配平该氧化还原反应的化学方程式:______________________。
②上述反应中被还原的元素是________,还原剂是________。
③反应生成0.3 mol H2O,则转移电子的数目为________mol。
(2)请配平下面化学方程式。
____CH3CH2OH+____KMnO4―→____CH3CHO+____MnO2+____KOH+____H2O。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
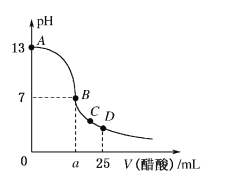
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:
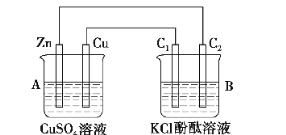
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为__________极,电极反应式为____________________________________________;
铜极为__________极,电极反应式为_____________________________________________;
石墨棒C1为__极,电极反应式为________;石墨棒C2附近发生的实验现象为
________________________________________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)________g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com