
【题目】下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
(2)写出表示管道煤气中的一氧化碳燃烧热的热化学方程式_________________________。
(3)充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、________等。
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中地理 来源: 题型:
【题目】根据下图回答下列问题。
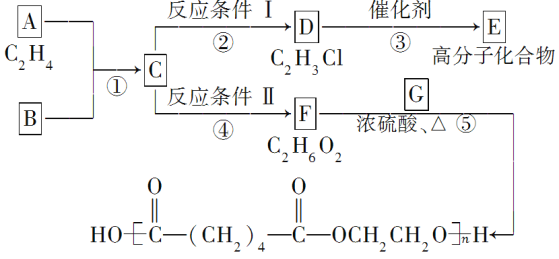
(1)写出A、E、G的结构简式:A___________,E____________,G_____________。
(2)反应②的化学方程式(注明反应条件)是___________________________;
反应④的化学方程式(注明反应条件)是________________________。
(3)写出反应①⑤的反应类型:①____________、⑤____________。
(4)写出反应⑤的化学方程式:______________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”填空:
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果________________;
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果________________;
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果________________;
(4)滴定前平视,滴定终了俯视,使滴定结果______________;
(5)滴定前仰视,滴定终了平视,使滴定结果______________;
(6)过早估计终点,使滴定结果__________________________;
(7)过晚估计终点,使滴定结果__________________________;
(8)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________________;
(9)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________________;
(10)洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】常温下,有两种溶液:①0.1 mol·L1 CH3COOH溶液 ②0. 1 mol·L1 CH3COONa溶液。
(1)溶液①的pH______7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是__________________________________________________。
(2)溶液②呈______性(填“酸”“碱”或“中”)。其原因是__________________________________
(用离子方程式和适当的叙述说明)。
(3)下列说法正确的是________(填序号)。
a.两种溶液中c(CH3COO)都等于0.1 mol·L1
b.两种溶液中c(CH3COO)都小于0.1 mol·L1
c.CH3COOH溶液中c(CH3COO)小于CH3COONa溶液中c(CH3COO)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。
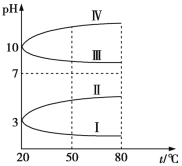
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
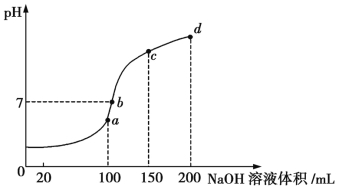
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:
NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度 (填“增大”“减小”或“不变”,下同),![]() 的浓度 。
的浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,此时溶液中浓度减小的粒子有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与加入的NaOH的物质的量之间的关系曲线。
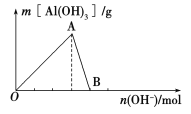
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与加入的NaOH的物质的量之间的关系曲线。
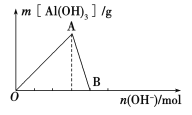
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com