
【题目】取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列 (填序号)。
【答案】(1)A-+H2O![]() HA+OH- (2)>
HA+OH- (2)>
(3)> (4)A>B>D>C
【解析】(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O![]() HA+OH-。
HA+OH-。
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1 mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7。
(4)(NH4)2SO4和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大,故答案为:A>B>D>C。


科目:高中地理 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①引发铝热反应的实验操作是 ,
产物中单质B是 。
(2)②中所发生的各反应的化学方程式为 、 。
(3)③中所发生的各反应的离子方程式为 、 。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017天津节选]某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
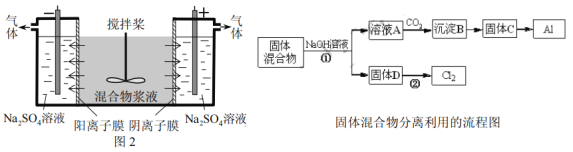
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
Ⅱ.含铬元素溶液的分离和利用
(2)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:__________________________________________________________________;
H2SO4:________________________________________________________________;
Ca(OH)2:______________________________________________________________;
KOH:________________________________________________________________;
NH4NO3:_____________________________________________________________;
KAl(SO4)2:____________________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ; 若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是(填图像符号) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前,c(HCl) c(NH3H2O)(填“大于”“小于”或“等于”,下同);混合前,酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:![]() +4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
+4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
①写出并配平该氧化还原反应的化学方程式:______________________。
②上述反应中被还原的元素是________,还原剂是________。
③反应生成0.3 mol H2O,则转移电子的数目为________mol。
(2)请配平下面化学方程式。
____CH3CH2OH+____KMnO4―→____CH3CHO+____MnO2+____KOH+____H2O。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】据图回答下列问题:

(1)若某人长期营养不良,血浆中蛋白质含量降低,会引起如图所示中哪一部分的液体增多? [ ]_______,其结果将会引起_________。
(2)目前普遍认为,____________是维持内环境稳态的主要调节机制。
(3)若某人患镰刀型细胞贫血症,则形态发生变化的是图中[ ] ,引起这种变化的根本原因是____________;直接原因是该细胞中____________结构异常,使其与______结合能力下降;因此该病主要是影响人体有氧呼吸第______阶段。
人体组织细胞中的一个CO2分子从产生处扩散到空气中至少需要通过_______层生物膜。
(4)若图示为肝脏的内环境,肝炎病人化验时,需制取相当于图中[ ]的液体,会发现转氨酶的含量偏高,这是因为肝炎病人肝细胞膜的通透性______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com