
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①引发铝热反应的实验操作是 ,
产物中单质B是 。
(2)②中所发生的各反应的化学方程式为 、 。
(3)③中所发生的各反应的离子方程式为 、 。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
【答案】(1)加少量KClO3,插上镁带并将其点燃 Fe
(2)Fe2O3+6HCl=2FeCl3+3H2O
MgO+2HCl=MgCl2+H2O
(3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+
(4)0.67 mol·L-1 2.3 mol·L-1
【解析】MgO不能与铝发生置换反应,所以①发生的反应是Fe2O3+2Al![]() 2Fe+Al2O3
2Fe+Al2O3
②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O
③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑
④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,溶液D为MgCl2、FeCl2的混合液。
根据题意假设20 g A中MgO和Fe2O3的物质的量均为x,
则:40 g·mol-1x+160 g·mol-1x=20 g,解得x=0.1 mol。
溶液中Mg2+的物质的量等于MgO的物质的量,c(Mg2+)=0.67 mol·L-1,反应后原加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,Cl-守恒,所以溶液D中:n(Cl-)=n(Mg2+)×2+n(Fe2+)×2=6.0 mol·L-1×0.15 L=0.9 mol,n(Fe2+)=0.35 mol,所以c(Fe2+)=2.3 mol·L-1。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中地理 来源: 题型:
【题目】将1 mol CH4和适量O2在密闭容器中混合点燃,充分反应后,CH4和O2均无剩余,且产物均为气体,质量为72 g,下列叙述正确的是( )
A.若将产物通过碱石灰,则可全部被吸收;若通入浓硫酸,则不能完全被吸收
B.产物的平均摩尔质量为20 g·mol-1
C.若将产物通过浓硫酸后恢复至室温,压强变为反应前的![]()
D.反应中消耗O256 g
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为:___________,其原子半径___________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为___________。
(2)铯与水起剧烈反应,放出___________色气体,同时使滴有紫色石蕊试液的溶液显___________色,因为___________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气体单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
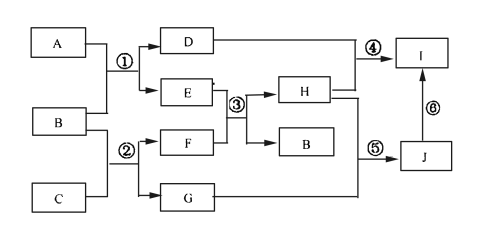
(1)写出C的电子式__________________。
(2)写出反应①的化学方程式______________________。
(3)列出两种E能发生的反应类型_________________________。
(4)写出过量的H与D溶液反应的离子方程式________________。
(5)实验室制取H的装置可以选用下列装置中的(填下图中的选项字母)。
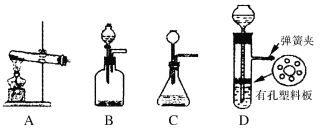
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请回答下列问题:
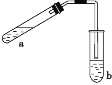
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,加入的操作顺序是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)写出实验中加热试管的目的:① ;② 。
(4)试管b中盛有饱和Na2CO3溶液,其作用是 。
(5)反应结束后,振荡试管b,静置,观察到的现象是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B混合产生无色气体;B+C混合产生白色沉淀;A+D产生白色沉淀;A+C混合无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):A________,B________,C________,D________。
(2)A+B反应的离子方程式为__________________________________。
(3)A+D反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】油脂是重要的营养物质。某天然油脂A可发生下列反应:
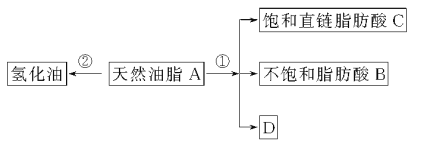
已知:A的分子式为C57H106O6。1 mol该天然油脂A经反应①可得到1 mol D、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:______________。
(2)写出反应①的反应类型:______________;C的名称(或俗称)是______________。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是______________。
a.氢化油又称人造奶油,通常又叫硬化油
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂
d.油脂的氢化与油脂的皂化都属于加成反应。
(4)D和足量金属钠反应的化学方程式:_______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列 (填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com