
����Ŀ���Ѱۣ����ʯ���� TiO2�����㷺�����������ɫ���ᡣ��ҵ������������Ҫ�ɷ�Ϊ FeTiO3������ Fe2O3 �� SiO2 �����ʣ�Ϊԭ�����Ѱ۵���Ҫ�������£�
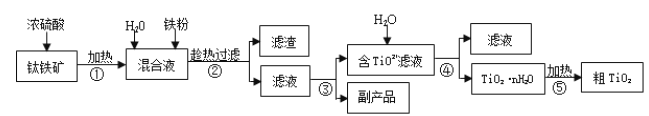
�ش��������⣺
��1���ڢڲ����������ijɷ���________��
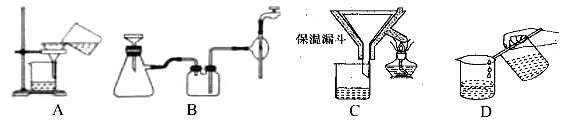
��2������������Ҫ�����������γ� TiO2��nH2O �ܽ����ù��չ�����Ҫ��ʵ��������ɣ����еġ����ˡ���������ѡ������װ��________����ѡ���
��3���ڢ۲���ʵ�������______�����ˣ��Ӷ���ø���Ʒ FeSO4��7H2O��
��4��Ϊ�ⶨ������������Һ��TiO2+��Ũ�ȣ�ȡ������Һ10 mL ������ˮϡ����100 mL������������ۣ������ʹ����ȫ��Ӧ��3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O�����˺�ȡ����Һ20.00 mL��������ʱ������Һ����ı仯���Բ��ƣ��������еμ�2��3 ��KSCN��Һ��ָʾ������ 0.1000 mol��L-1NH4Fe(SO4)2 ����Һ�ζ�����Һ���ֺ�ɫ����ʱ��Һ�� Ti3+ȫ��������Ϊ Ti4+�����ı�Һ30.00mL���ش��������⣺
�����в�����ʹ���� TiO2+Ũ��ƫ�ߵ���______��
A. �����Ʊ�Һ�Ĺ����У�δϴ���ձ��Ͳ�����
B. �����Ʊ�Һ�����Ǹ��ӿ̶���
C��������ˮϴ�Ӻ�δ����ϴ�ĵζ���ȡ����Һ
D���ڵζ��յ����ʱ���ӵζ��̶ܿ���
����ô�����Һ�� TiO2+�����ʵ���Ũ����______��
��5����ѧ�Ҵӵ��ұ�����Ĺ����еõ��������ҳ���ұ���ѵ��¹��ա�TiO2 ֱ�ӵ�ⷨ�����ѣ������Ϊ���ڵ��Ȼ��ƣ�ԭ����ͼ��ʾ��

д�������缫��Ӧʽ___________��
���𰸡�Fe��SiO2 C ����Ũ������ȴ�ᾧ AD 1.500 mol��L��1 TiO2��4e��=Ti��2O2��
��������
(1)�������к��е� SiO2 ���������ᣬ�ӻ��Һ�м����˹�����Fe�ۣ���ԭ��Һ�е�Fe3+����ڢڲ����������ijɷ���SiO2 ������Fe��
(2)����������Ҫ�����¶����γ� TiO2��nH2O �ܽ�����Ӧѡ����©����ɡ����ˡ���������ѡ��C�������⣬��ΪC��
(3)���ڢڲ�������Һͨ������ ����Ũ������ȴ�ᾧ���ٹ��ˣ��ɵõ�FeSO4��7H2O��
(4)��A�������Ʊ�Һ�Ĺ����У�δϴ���ձ��Ͳ���������Һ��Ũ�Ƚ��ͣ����ĵı�Һ������������� TiO2+Ũ��ƫ�ߣ���A��ȷ��B�������Ʊ�Һ�����Ǹ��ӿ̶��ߣ���Һ���ƫС����Һ��Ũ�Ƚ������ĵı�Һ�����С���������� TiO2+Ũ��ƫ�ͣ���B����C��������ˮϴ�Ӻ�δ����ϴ�ĵζ���ȡ����Һ������Һ��ˮϡ�ͣ�Ũ��ƫ�ͣ���C����D���ڵζ��յ����ʱ���ӵζ��̶ܿ��ߣ���Һ�����ƫ�������� TiO2+Ũ��ƫ�ߣ���D��ȷ����ΪAD��
�����ı�Һ�����ʵ���Ϊ 0.1000 mol��L-1��0.03 L=3��10-3 mol�����ݵ����غ㣬��֪��Һ��Ti3+�����ʵ���Ϊ3��10-3 mol������Һ��TiO2+�����ʵ���Ϊ3��10-3 mol����Һ�� TiO2+�����ʵ���Ũ����3��10-3 mol��0.02 L=1.500 mol��L��1��
(5)���ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��͵�Դ�����������缫��ӦʽΪTiO2+4e-=Ti+2O2-��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��The secretary arranged a(n)___time and place for the applicants to have an interview
A.important
B.spare
C.public
D.convenient
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ������һ�ೣ�������ʣ���������ͨ��һ����Ӧ��ֱ���γ��ε���
���������� ������������ ���� ���ǽ������� ������������ ����
A���٢ڢ� B���٢ܢ�
C���ڢݢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ���ñ���KOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ���ⶨ���ƫ�ͣ���ԭ�������( )
A�����Ʊ���Һ�Ĺ���KOH�л���NaOH����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ
D���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ե������Һ�����µĹ����ܽᣨ���ڳ����£�����֪����ƽ�ⳣ����CH3COOH��H2CO3��C6H5OH ��HCO![]() �����в���ȷ���� �� ��
�����в���ȷ���� �� ��
A. pH��ȵ�������Һ��a��CH3COONa b��C6H5ONa c��NaHCO3 d��NaOH����������Һ�����ʵ����ʵ���Ũ����С����˳��Ϊ��d < b < c < a
B. pH=8.3��NaHCO3��Һ��c(Na��) �� c(HCO3��) �� c(CO32��)�� c(H2CO3)
C. pH��2��һԪ����pH��12�Ķ�Ԫǿ��������ϣ�c(OH��)��c(H��)
D. pH��4Ũ�Ⱦ�Ϊ0.1mol��L��1��CH3COOH��CH3COONa�����Һ�У�c(CH3COO��)��c(OH��) �� c(CH3COOH)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��
��1��ͼ���������У���ȷ��ӳ������ˮ��ˮ�岹����ϵ���ǣ� ��
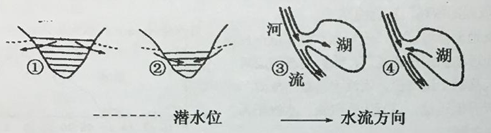
A���٢� B���٢� C���ڢ� D���ڢ�
��2����ͬ���͵�ˮѭ�����뾭���Ļ����ǣ� ��
A��ˮ������ B���ر����� C������ D������
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����˵������ȷ����
A�������������ᴿ����
B�����塢��Һ����Һ�����ַ�ɢϵ�ĸ��������Ƿ�ɢ������ֱ���Ĵ�С
C����������������ֽ
D����25 mL��ˮ����μ���1~2 mL FeCl3������Һ,������п��Ƶ�Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ������(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200��9kJ��mol��1
NO(g)��1/2O2(g)=NO2(g) ��H=��58��2kJ��mol��1
SO2(g)��O3(g)=SO3(g)��O2(g) ��H=��241��6kJ��mol��1
��1����Ӧ3NO(g)��O3(g)=3NO2(g)����H=_______mol��L��1��
��2�����������̶����뷴Ӧ����NO��SO2�����ʵ������ı����O3�����ʵ�������Ӧһ��ʱ�����ϵ��n(NO)��n(NO2)��n(SO2)�淴Ӧǰn(O3)��n(NO)�ı仯��ͼ��
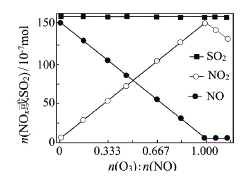
����n(O3)��n(NO)>1ʱ����Ӧ��NO2�����ʵ�����������ԭ����__________��
������n(O3)��O3����SO2�ķ�Ӧ��������Ӱ���������ԭ���� _________��
��3������CaSO3ˮ����Һ���վ�O3Ԥ����������ʱ����Һ(pHԼΪ 8)��SO32����NO2ת��ΪNO2���������ӷ���ʽΪ��___________��
��4��CaSO3ˮ����Һ�м���Na2SO4��Һ���ﵽƽ�����Һ��c(SO32��)=________[��c(SO42��)��Ksp(CaSO3)��Ksp(CaSO4)��ʾ]��CaSO3ˮ����Һ�м���Na2SO4��Һ�����NO2���������ʣ�����Ҫԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����е��� ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��0.1mol/LCH3COONa��0.1mol/LHCl��Һ�������ϣ�c(Na��)��c(Cl��)��cCH3COO��)��c(OH��)
B��0.1mol/LNH4Cl��0.1mol/L��ˮ�������ϣ�pH��7����c(NH3��H2O)��c(NH4��)��c(Cl��)��c(OH��)
C��0.1mol/LNa2CO3��0.1mol/L NaHCO3��Һ�������ϣ�![]() c(Na��)��c(CO32��)��c(HCO3��)��c(H2CO3)
c(Na��)��c(CO32��)��c(HCO3��)��c(H2CO3)
D��0.1mol/LNa2C2O4��0.1mol/LHCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��
2c(C2O42��)��c(HC2O4��)��c(OH��)��c(Na��)��c(H��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com