
【题目】下表所示是几种弱电解质的电离平衡常数和某难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 电离平衡常数 | Ksp |
CH3COOH | CH3COOH | 1.76×105 | |
H2CO3 | H2CO3 HC | Ka1=4.31×107 Ka2=5.61×1011 | |
C6H5OH | C6H5OH | 1.1×1010 | |
H3PO4 | H3PO4
| Ka1=7.52×103 Ka2=6.23×108 Ka3=2.20×1013 | |
NH3·H2O | NH3·H2O | 1.76×105 | |
BaSO4 | BaSO4(s) | 1.07×1010 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②![]() ,③C6H5OH,④
,③C6H5OH,④![]() 均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
(2)25 ℃时,将等体积、等浓度的CH3COOH溶液和氨水混合,混合液中:c(CH3COO) (填“>”“=”或“<”)c(![]() )。
)。
(3)25 ℃时,向10 mL 0.01 mol·L1苯酚溶液中滴加V mL 0.01 mol·L1氨水,下列说法正确的是 (填序号)。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(![]() )>c(C6H5O)>c(H+)>c(OH)
)>c(C6H5O)>c(H+)>c(OH)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(![]() )=c(C6H5O)+c(C6H5OH)
)=c(C6H5O)+c(C6H5OH)
(4)如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是 (填序号)。
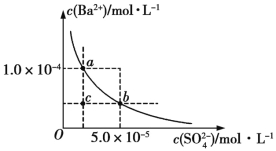
A.加入Na2SO4可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
【答案】(1)①④③② (2)= (3)D (4)D
【解析】解答本题的关键是理清电离平衡常数、溶度积的含义及影响因素。(1)根据电离平衡常数的大小可判断酸的相对强弱,平衡常数越小,酸性越弱。(2)将等体积、等浓度的CH3COOH溶液和氨水混合,恰好生成CH3COONH4,由于CH3COOH和NH3·H2O的电离平衡常数相等,所以![]() 和CH3COO的水解程度相同,故混合液中c(CH3COO)=c(
和CH3COO的水解程度相同,故混合液中c(CH3COO)=c(![]() )。(3)A项错误,
)。(3)A项错误, +NH3·H2O
+NH3·H2O![]()
![]() +H2O,
+H2O,![]() 的水解程度远远大于
的水解程度远远大于![]() 的水解程度,V略小于10时,pH也可能大于7;B项错误,该式不符合电荷守恒;C项错误,
的水解程度,V略小于10时,pH也可能大于7;B项错误,该式不符合电荷守恒;C项错误,![]() 促进水的电离,而
促进水的电离,而![]() 抑制水的电离;D项正确,当V=5时,是
抑制水的电离;D项正确,当V=5时,是![]() 和
和![]() 的混合溶液,且二者的物质的量相等,根据物料守恒可判断该式正确。(4)A项正确,温度不变,Ksp不变,c(
的混合溶液,且二者的物质的量相等,根据物料守恒可判断该式正确。(4)A项正确,温度不变,Ksp不变,c(![]() )增大,c(Ba2+)减小;B项正确,曲线上方区域(不含曲线)的任意一点均为过饱和溶液,均有BaSO4沉淀生成;C项正确,蒸发溶剂,c(
)增大,c(Ba2+)减小;B项正确,曲线上方区域(不含曲线)的任意一点均为过饱和溶液,均有BaSO4沉淀生成;C项正确,蒸发溶剂,c(![]() )和c(Ba2+)均增大,而由c点到a点c(
)和c(Ba2+)均增大,而由c点到a点c(![]() )保持不变,由c点到b点c(Ba2+)保持不变,故溶液可能由c点变为曲线上a、b之间的某一点(不含a、b);D项错误,升高温度,Ksp增大,c(Ba2+)和c(
)保持不变,由c点到b点c(Ba2+)保持不变,故溶液可能由c点变为曲线上a、b之间的某一点(不含a、b);D项错误,升高温度,Ksp增大,c(Ba2+)和c(![]() )均应增大。
)均应增大。


科目:高中地理 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目: ___________________________________________________________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知:25 ℃时某些弱酸的电离平衡常数如表。
CH3COOH | HClO | H2CO3 |
Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下面图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
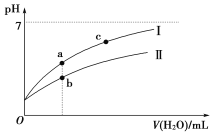
(1)相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是____________________。
(2)向NaClO溶液中通入少量二氧化碳的离子方程式为______________。
(3)图像中a、c两点处的溶液中![]() ________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
(4)图像中a点酸的总浓度________(填“大于”“小于”或“等于”)b点酸的总浓度。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017江苏]常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.76×105,下列说法正确的是
A.浓度均为0.1 mol·L1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L1 HCOOH与0.1 mol·L1 NaOH 等体积混合后的溶液中:c(HCOO) + c(OH) = c(HCOOH) + c(H+)
D.0.2 mol·L1 CH3COONa 与 0.1 mol·L1盐酸等体积混合后的溶液中(pH<7):c(CH3COO) > c(Cl ) > c(CH3COOH) > c(H+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④分别是
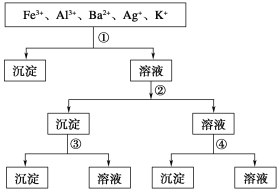
A.①NaCl、②NaOH、③NH3·H2O、④H2SO4
B.①H2SO4、②NaOH、③NH3·H2O、④NaCl
C.①H2SO4、②NH3·H2O、③NaOH、④NaCl
D.①NaCl、②NH3·H2O、③NaOH、④H2SO4
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。
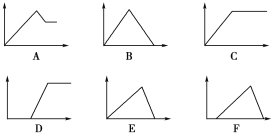
溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | |
②AlCl3溶液 | 通过量NH3 | |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。
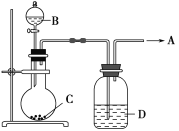
(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是___________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是___________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是____________。所制得的气体用________法收集。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O===2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
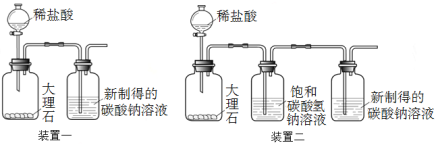
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ②利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 ②利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】You can borrow my car ___ you promise not too fast.
A. unless
B. even
C. in case
D.a s long as
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com