
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④分别是
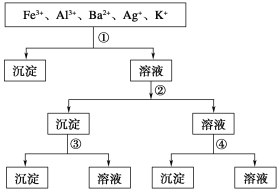
A.①NaCl、②NaOH、③NH3·H2O、④H2SO4
B.①H2SO4、②NaOH、③NH3·H2O、④NaCl
C.①H2SO4、②NH3·H2O、③NaOH、④NaCl
D.①NaCl、②NH3·H2O、③NaOH、④H2SO4
科目:高中地理 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
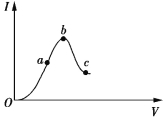
(1)O点为什么不导电___________________________。
(2)a、b、c三点c(H+)由大到小的顺序是______________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】和下列离子反应方程式相对应的化学方程式正确的是
A.Cu2++2OH===Cu(OH)2——CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.Ba2++![]() ===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.Ag++Cl===AgCl↓——AgNO3+NaCl===AgCl↓+NaNO3
D.Cu+2Ag+===Cu2++2Ag↓——Cu+2AgCl===2Ag+CuCl2
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。
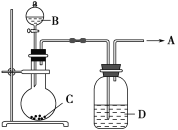
(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_____________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是_____________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是______________________。所制得的气体用________法收集。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为:________________________________。
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_________________________________。
(4)检验Fe3+存在的最佳试剂是____________,现象是______________________________________。
(5)写出Fe与H2O(g)在一定条件下反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下表所示是几种弱电解质的电离平衡常数和某难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 电离平衡常数 | Ksp |
CH3COOH | CH3COOH | 1.76×105 | |
H2CO3 | H2CO3 HC | Ka1=4.31×107 Ka2=5.61×1011 | |
C6H5OH | C6H5OH | 1.1×1010 | |
H3PO4 | H3PO4
| Ka1=7.52×103 Ka2=6.23×108 Ka3=2.20×1013 | |
NH3·H2O | NH3·H2O | 1.76×105 | |
BaSO4 | BaSO4(s) | 1.07×1010 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②![]() ,③C6H5OH,④
,③C6H5OH,④![]() 均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
(2)25 ℃时,将等体积、等浓度的CH3COOH溶液和氨水混合,混合液中:c(CH3COO) (填“>”“=”或“<”)c(![]() )。
)。
(3)25 ℃时,向10 mL 0.01 mol·L1苯酚溶液中滴加V mL 0.01 mol·L1氨水,下列说法正确的是 (填序号)。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(![]() )>c(C6H5O)>c(H+)>c(OH)
)>c(C6H5O)>c(H+)>c(OH)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(![]() )=c(C6H5O)+c(C6H5OH)
)=c(C6H5O)+c(C6H5OH)
(4)如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是 (填序号)。
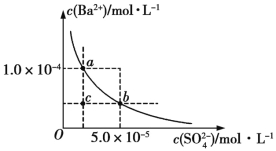
A.加入Na2SO4可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题。
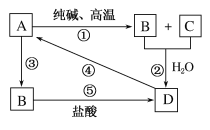
(1)A的用途为________(任写一种),B是________,D是________。
(2)写出化学方程式:
①________________________________________。
④________________________________________。
(3)写出离子方程式:
②___________________________________________。
③___________________________________________。
⑤___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com