
【题目】和下列离子反应方程式相对应的化学方程式正确的是
A.Cu2++2OH===Cu(OH)2——CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.Ba2++![]() ===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.Ag++Cl===AgCl↓——AgNO3+NaCl===AgCl↓+NaNO3
D.Cu+2Ag+===Cu2++2Ag↓——Cu+2AgCl===2Ag+CuCl2
科目:高中地理 来源: 题型:
【题目】[2017江苏]铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
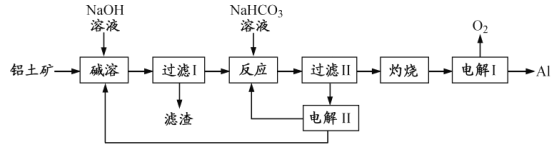
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
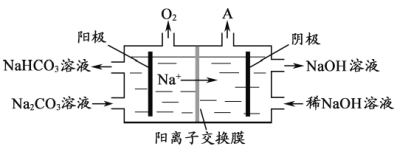
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】实验室欲测定某NaOH溶液的物质的量浓度,用0.100 mol·L-1 HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
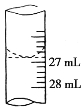
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)甲同学在实验过程中,记录滴定前滴定管内液面读数0.50 mL,滴定后液面如图所示,则此时消耗标准溶液的体积为 。
(3)乙同学做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.100 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
读取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留三位有效数字)。
(4)下列操作会使测定结果偏高的是 (填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前酸式滴定管读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
Al2O3+2Fe所属基本反应类型是 。在该反应中 元素的化合价升高,该元素的原子 电子,被 。该反应中,Fe2O3发生了 反应,Al发生了 反应, 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知:25 ℃时某些弱酸的电离平衡常数如表。
CH3COOH | HClO | H2CO3 |
Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下面图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
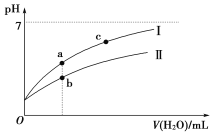
(1)相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是____________________。
(2)向NaClO溶液中通入少量二氧化碳的离子方程式为______________。
(3)图像中a、c两点处的溶液中![]() ________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
(4)图像中a点酸的总浓度________(填“大于”“小于”或“等于”)b点酸的总浓度。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】把18.0 mol·L1的浓硫酸稀释成1.80 mol·L1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取 mL的18.0 mol·L1的浓硫酸;
②将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
③将已冷却至室温的H2SO4溶液沿玻璃棒注入 mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线 mL处;
⑥改用 逐滴加蒸馏水,使溶液凹液面的最低处恰好与刻度线相平;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水 。
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线 。
(3)容量瓶上标有 (选填下列编号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④分别是
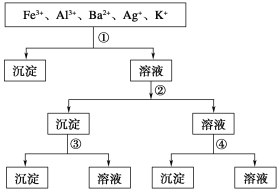
A.①NaCl、②NaOH、③NH3·H2O、④H2SO4
B.①H2SO4、②NaOH、③NH3·H2O、④NaCl
C.①H2SO4、②NH3·H2O、③NaOH、④NaCl
D.①NaCl、②NH3·H2O、③NaOH、④H2SO4
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】When you use up all the electricity in the battery, the phone stops working you recharge it.
A. if B. since C. although D. until
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com