
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
【答案】(1)
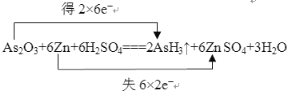 (3分)
(3分)
(2)A(1分)
(3)ZnSO4(1分) AsH3(1分)
(4)1.2NA(2分)
【解析】(1)在As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
(2)As2O3中As元素的化合价降低,发生还原反应,作氧化剂,所以表现为氧化性。
(3)该反应中Zn被氧化,氧化产物是ZnSO4,As被还原,还原产物是AsH3。
(4)由双线桥可知,生成2 mol AsH3,转移电子12 mol,若生成0.2 mol AsH3,则转移电子的物质的量是1.2 mol,电子数是1.2NA。


科目:高中地理 来源: 题型:
【题目】实验室制备酚醛树脂的实验装置如图所示,主要步骤如下:
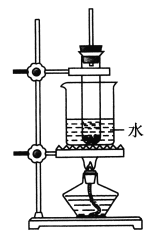
(1)在大试管中加入2 g苯酚和3 mL 40%的甲醛溶液。
(2)再加入1 mL浓盐酸,装好实验装置。
(3)将试管水浴加热至沸腾,到反应不再剧烈进行时,过一会儿便可停止加热。
(4)取出试管中的黏稠固体,用水洗净得到产品。
填写下列空白:
(1)在装置中,试管口加一带塞的长直导管的作用是________________。
(2)加入浓盐酸的作用是________。若要形成网状结构的酚醛树脂还可用________代替浓盐酸。
(3)此反应需水浴加热,不用温度计控制水浴温度的原因是__________________。
(4)采用水浴加热的好处是____________________。再列举两个需要水浴加热的有机实验,写出实验的名称:____________________。
(5)生成的酚醛树脂为________色________状物质。
(6)实验完毕后,若试管用水不易洗涤,可以加入少量________浸泡几分钟,然后洗净。
(7)写出实验室制取酚醛树脂的化学方程式:_______________________,此有机反应类型是________。
(8)该实验装置中的一处错误是_______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
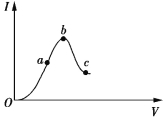
(1)O点为什么不导电___________________________。
(2)a、b、c三点c(H+)由大到小的顺序是______________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
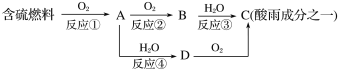
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中![]() 和
和![]() 浓度的比值c(
浓度的比值c(![]() )∶c(
)∶c(![]() )=________。
)=________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)常温时向水中加入少量固体MgCl2,________(填“促进”或“抑制”)了水的电离;与纯水相比,所得溶液中KW________(填“变大”“变小”或“不变”)。
(2)现有下列溶液:①20 mL 0.1 mol·L-1 H2SO4溶液;②40 mL 0.1 mol·L-1 CH3COOH溶液;③40 mL 0.1 mol·L-1 HCl溶液;④40 mL 0.1 mol·L-1 NaOH溶液;⑤20 mL 0.1 mol·L-1 Ba(OH)2溶液,其中:
A.c(H+)最小的是________(填序号)
B.任取2份溶液混合,混合溶液的pH为7,有________种取法。
C.②④混合后,溶液的pH________7(填“大于”“小于”或“等于”)。
D.混合后出现白色沉淀的两种溶液是________。(填序号)
(3)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。则:
①B是________溶液,C是________。
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填数据)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】和下列离子反应方程式相对应的化学方程式正确的是
A.Cu2++2OH===Cu(OH)2——CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.Ba2++![]() ===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.Ag++Cl===AgCl↓——AgNO3+NaCl===AgCl↓+NaNO3
D.Cu+2Ag+===Cu2++2Ag↓——Cu+2AgCl===2Ag+CuCl2
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。
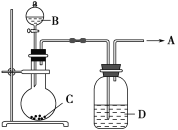
(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_____________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是_____________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是______________________。所制得的气体用________法收集。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com