
要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
第二组 | NaOH | HCl | NaCl | Na2O | CO |
第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
每组分类均有错误,其错误的物质分别是__________(填化学式,下同)、__________、_________。
(2)鉴别胶体和溶液所采用的方法是观察是否能发生__________现象。
(3)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | X | 26 | 3 | 30 |
①该变化的基本反应类型是___________反应; ②物质Q在反应中起的作用是__________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
CO2溶于水生成碳酸。已知下列数据:
弱电解质 | H2CO3 |
|
电离平衡常数(250C) | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下1 mol· L-1的(NH4)2CO3溶液,已知NH4+的水解平衡常数 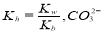 第一步水解的平衡常数
第一步水解的平衡常数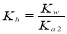 。下列说法正确的是
。下列说法正确的是
A.由数据可判断该溶液呈酸性
B.c(NH4+)>c(HCO3-)>c(CO32-)>c(NH3·H2O)
C.c(NH4+)+c(NH3·H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:计算题
(1)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为__mol,生成1 mol Cu3P时,参加反应的P的物质的量为_____mol
(2)将0?2 mol KMnO4在一定温度下加热后生成a mol O2(a≠0);将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的取值范围为________ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
下列数量的各物质所含原子数按由大到小的顺序排列是
①0.45 mol氨气
②标准状况下33.6 L氦气
③4℃时7.5mL水
④0.2 mol磷酸钠(Na3PO4)
A.①④②③ B.②①④③
C.②①③④ D.①④③②
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:简答题
已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B。其转化关系如图所示:

(1)将B中所含元素填写在下表的恰当位置中(用元素符号表示)

(2)已知反应 一是放热反应,画出能量关系示意图。
一是放热反应,画出能量关系示意图。

(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和______________。
(4)方法一的化学方程式是_________________。
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是______(填“方
法一”或“方法二”),理由是______________。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:___________________。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制得Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:______________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因:__________。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:_________________________。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和NaSO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示:
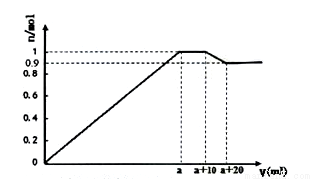
①写出(a+10)到(a+20)过程中反应的离子方程式:_____________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)=mol
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,下列叙述错误的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl的溶液含NH的物质的量不同
查看答案和解析>>
科目:高中化学 来源:2016届山西省晋中市四校高三上学期期中联考化学试卷(解析版) 题型:推断题
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
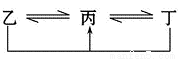
(1)单质B的结构式:_____ ____。
(2)F元素周期表中的位置:_____ _____。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。均含有D元素的乙与丁在溶液中发生反应的离子方程式_______ 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34。其中庚的熔沸点比辛_________(填“高”或“低”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁比含杂质的铁易被腐蚀
②在人体的血红蛋白中含有铁元素
③铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
④铁与强氧化剂硝酸反应的产物只有一种是Fe(NO3)3
⑤不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②③ C.②⑤ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com