
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
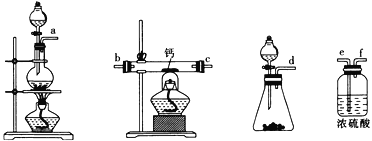
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。
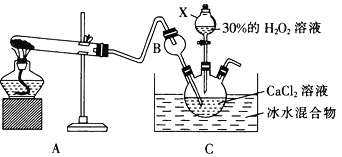
①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
【答案】(1)①2CaO2+4HCl=2CaCl2+2H2O+O2↑②H2O2(2)①d→e→f→b→c→e(或d→e→f→c→b→e)
②熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞。
(3)①中和生成的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2·8H2O的溶解,或提高产品的产率等,其他合理答案)②烧杯、漏斗、玻璃棒;沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次。(4)在FeCl3溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强。
【解析】
试题(1)① CaO2与盐酸反应产生CaCl2、H2O和氧气,反应的化学方程式为2CaO2+ 4HCl= 2CaCl2+ 2H2O+O2↑;②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2;该物质具有氧化性,将红色的物质氧化变为无色;(2)用H2O2与MnO2反应产生O2,用浓硫酸干燥,氧气,燃烧是氧气与Ca在加热时发生反应产生CaO2,为防止空气中的水份影响反应产物,应该再通过盛有浓硫酸的洗气瓶。故装置的连接顺序是d→e→f→b→c→e(或d→e→f→c→b→e);②根据完整的实验装置进行实验,实验步骤如下:I.检验装置的气密性后,装入药品;II.打开分液漏斗活塞,通入气体一段时间,加热药品;III反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;IV拆除装置,取出产物。①根据反应方程式可知NH3与反应产生的H+结合形成NH4+,所以在Ca2+和 H2O2 的反应过程中所起的作用是中和生成的氢离子,促进反应进行;②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次;(4)证明CaO2的氧化性比FeCl3的氧化性强实验是在FeCl3溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强。


科目:高中化学 来源: 题型:
【题目】下列各组中的比值等于2∶1的是
A. K2S溶液中c(K+)与c(S2-)之比
B. pH都为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比
C. 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比
D. 室温时,将pH=5的H2SO4溶液稀释1000倍,稀释后溶液中的c(H+)与c (SO42-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
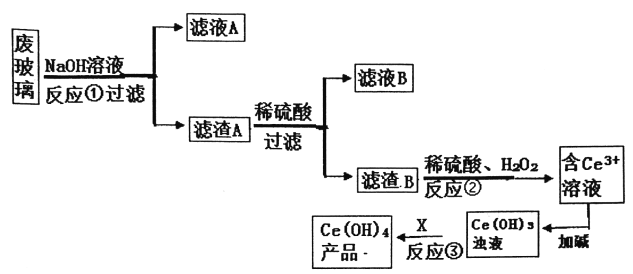
己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)废玻璃在NaOH溶液浸洗前往往要进行的操作________,反应①的离子方程式_______。
(2)反应②的离子方程武是____________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______。
(4)反应③需要加入的试剂X可以是_________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_______若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2;控制pH是为了使Al3+转化为A1(OH)3进入固体2
C. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某Al2(SO4)3溶液VmL中含有a克Al3+,取出![]() mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则其中CO2所占的体积为______,CO所占的质量为______。
(3)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。
①配制该营养液后c(NH4+)=0.016mol/L,溶液中c(K+)=_______________。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 将纯碱和硫酸反应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D |
| 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液为无色,请回答:
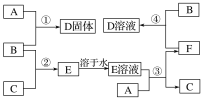
(1)A是__________,B是__________,C是_______________(填写化学式)。
(2)反应①的化学方程式为_______________________________。
(3)反应③的化学方程式为________________________________________。
(4)反应④的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的SO32-:试液![]() 气体
气体![]() 褪色
褪色
C. 检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com