
【题目】下列各组中的比值等于2∶1的是
A. K2S溶液中c(K+)与c(S2-)之比
B. pH都为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比
C. 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比
D. 室温时,将pH=5的H2SO4溶液稀释1000倍,稀释后溶液中的c(H+)与c (SO42-)之比
【答案】B
【解析】
A.因为S2-会水解,导致数目减少,比值会大于2:1,故A错误;
B.两者都是强碱,NaOH是一元碱Ba(OH)2,是二元碱,pH相同,所以NaOH的浓度是Ba(OH)2的2倍,故B正确;
C.醋酸是弱酸,浓度越大,电离越小,所以0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比小于2:1,故C错误;
D.pH为5的H2SO溶液中, c(H+)=10-5mol/L, c(SO42-)=![]() C(H+)=5×10-6mol/L;溶液稀释1000倍后,c(H+)只能近似为:1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×1/1000=5×10-9mol/L,所以稀释后溶液中C(H+)与c(SO42-)的比值近20:1;故D错误;
C(H+)=5×10-6mol/L;溶液稀释1000倍后,c(H+)只能近似为:1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×1/1000=5×10-9mol/L,所以稀释后溶液中C(H+)与c(SO42-)的比值近20:1;故D错误;
本题答案为B。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
A. ①③⑤ B. ②④⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)![]() B(g) 2C(g)的平衡常数和温度的关系如下:
B(g) 2C(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1)该反应的平衡常数表达式K![]() ____________,
____________,![]() ______0(填“﹤”“﹥”或“≒”)
______0(填“﹤”“﹥”或“≒”)
(2)容积固定,判断该反应是否达到平衡的依据为_______(填正确选项前的字母)。
a.气体的密度不随时间改变
b.![]() (A)不随时间改变
(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变
d.压强不随时间改变
(3)1200℃时反应2C(g) ![]() A(g)
A(g)![]() B(g)的平衡常数值为____________。
B(g)的平衡常数值为____________。
(4)830℃时,向一个10.00L的密闭容器中充入0.40 mol的A和1.60 mol的B,如果反应初始2s内生成C的物质的量为0.40 mol,则2s内A的平均反应速率![]() (A)=____________
(A)=____________
mol·L-1·s-1;2s时![]() (B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
(B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6HnO7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙 醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。

请回答下列问题:
(1) 与普通漏斗比较,a漏斗的优点是______________
(2)按上图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2 .
①b中的实验现象____________________
②一段时间后,关闭_____,打开______(选填K1 ,K2或K3)。观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是______________________________.
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因.____________________________________
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是 _______.
向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是_______________。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (X)、
(X)、![]() (Y)互为同分异构体,下列说法不正确的是
(Y)互为同分异构体,下列说法不正确的是
A. Y的一氯代物只有三种
B. X的所有原子可能处于同一平面
C. X、Y与足量氢气完全加成时所需氢气的物质的量之比为1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑+ 2H2O
(1)浓盐酸在反应中显示出来的性质是 ________(填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为 ___________;
(3)该反应中氧化产物与还原产物的质量比为____________;
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目______
(5)铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是__________ (填写字母)
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+ C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式 __________________________________。
(3)写出下列反应的离子方程式:
①D+盐酸 ________________________________________________;
②B+水 _____________________________________________________;
③D+A ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,pH变化曲线如下图所示:
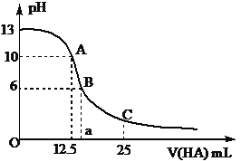
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=____ mol·L-1。
(3)B点所示溶液中,c(CH3COO-)-c(Na+)=_______________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(4)C点所示溶液中,c(CH3COOH)_______c(CH3COO-)。(填“>”、“<”或“=”)
(5)向300 mL上述NaOH溶液中通入448 mL CO2(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是________.
A.c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B.2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com