
【题目】已知![]() (X)、
(X)、![]() (Y)互为同分异构体,下列说法不正确的是
(Y)互为同分异构体,下列说法不正确的是
A. Y的一氯代物只有三种
B. X的所有原子可能处于同一平面
C. X、Y与足量氢气完全加成时所需氢气的物质的量之比为1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
【答案】C
【解析】
考查有机物的基础知识,涉及等效氢的判断、共面、共线、官能团的形式等知识,应从各有机物代表物入手进行分析;
A、 ,该有机物有3种不同的氢原子,因此一氯代物有3种,故A说法正确;
,该有机物有3种不同的氢原子,因此一氯代物有3种,故A说法正确;
B、苯环空间构型为平面正六边形,CH2=CH2属于平面结构,由于碳碳单键可以旋转,因此X中所有原子可能处于同一平面,故B说法正确;
C、1mol苯环与氢气发生加成,最多消耗3molH2,1mol“C=C”最多消耗1molH2,1个X分子中含有1个苯环和1个“C=C”,因此1molX最多消耗4molH2,1molY最多消耗3molH2,因此所需氢气的物质的量之比为4:3,故C说法错误;
D、根据结构简式,X和Y中都含有“C=C”,与溴水发生加成反应,且溴水褪色的原理相同,故D说法正确。


科目:高中化学 来源: 题型:
【题目】资料显示:浅绿色的FeSO4·7H2O加热失水为FeSO4·H2O时呈白色,成FeSO4时为无色固体。FeSO4经加热可分解为FeO和SO3,经强热可分解为Fe2O3、SO3和SO2。SO3的熔点为16.8℃,沸点为44.8℃。化学兴趣小组对上述资料进行实验探究。
第一步:用绿矾制无水硫酸亚铁。
(1)把药品装在仪器(写名称)____中进行加热,已将结晶水除净的依据是(选填序号)___。
A.观察无水蒸汽产生 B.经恒重操作最后两次称量所得到的质量完全相同
C.晶体完全变为无色 D.经恒重操作最后两次质量差不超过天平感量误差
第二步:取一定量无水硫酸亚铁置于如图(部分夹持仪器略去)所示A的试管中进行加热。
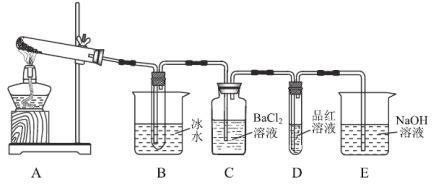
(2)实验过程中C、D、E中除有少许气泡外无其它明显现象。若将B试管中产生的少量固体溶于水,检验该溶液中的阴离子的方法是:___。实验过程中还有一处明显的现象是:________________。
第三步:将第二步实验的装置中A、B部分改为如图所示的![]() 、
、![]() ,C,D,E不变(C,E中都装有足量溶液)。
,C,D,E不变(C,E中都装有足量溶液)。
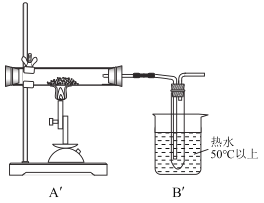
同样取一定量无水硫酸亚铁置于![]() 的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
(3)实验中![]() 的玻璃管中的现象是:______,说出
的玻璃管中的现象是:______,说出![]() 装置的一个作用是:________。
装置的一个作用是:________。
最后将C中液体完全取出进行过滤、洗涤、干燥。称得所得固体质量为23.300g,所得溶液加水稀释定容为1L,取出20.00mL置于锥形瓶中,用已知浓度的标准NaOH溶液测定该1L溶液中一种溶质的浓度。
(4)上述实验过程中用到的定量仪器有_______,用到的指示剂是_______。
(5)将所得溶液加水定容时,加水所用的仪器名称为_____,若去称量![]() 玻璃管中残留固体的质量应接近于____g。
玻璃管中残留固体的质量应接近于____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。

②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、![]() 的混合液,经测定溶液中
的混合液,经测定溶液中![]() 与
与![]() 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的![]() 的分子个数比为( )
的分子个数比为( )
A.21:5B.11:3C.5:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的比值等于2∶1的是
A. K2S溶液中c(K+)与c(S2-)之比
B. pH都为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比
C. 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比
D. 室温时,将pH=5的H2SO4溶液稀释1000倍,稀释后溶液中的c(H+)与c (SO42-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。

回答下列问题:
(1)仪器P的名称是_______。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH过低会使产率下降,其原因是______;柠檬酸的作用还有_____(填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____(填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着低碳钢等洁净钢技术的发展,![]() 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。
请回答下列问题:
(1)日常生活中铝用品比铁器件更耐腐蚀,原因是________。
(2)在埋炭实验条件下,不同碳素材料的![]() 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:
①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]() ;
;
则![]() 的
的![]() ______
______![]() 。
。
(3)实验温度下,(![]() )/Fe系统中存在着相互反应,如
)/Fe系统中存在着相互反应,如![]() 溶入铁液中,导致铁液中平衡的铝的百分含量的对数(lg[Al])和平衡氧(
溶入铁液中,导致铁液中平衡的铝的百分含量的对数(lg[Al])和平衡氧(![]() )的百分含量的对数(lg[
)的百分含量的对数(lg[![]() ])关系如图所示,图中温度
])关系如图所示,图中温度![]() ___1973K(填“>”或“<”).
___1973K(填“>”或“<”).

(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:![]() 。在实验室研究该反应,一定温度下.向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下.向某体积可变的恒压密闭容器(总压强为![]() )加入足量的碳和1mol
)加入足量的碳和1mol![]() ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:

①650℃时,该反应达到平衡后吸收的热量是_____,清耗碳的质量为____。
②T℃时,若向平衡体系中再充入一定量以V![]() ):V(
):V(![]() )=5:4的混合气体,平衡___(填“向正反应方向”“向逆反应方向”或“不”)移动。
)=5:4的混合气体,平衡___(填“向正反应方向”“向逆反应方向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数![]() =__[用含
=__[用含![]() 的代数式表示,气体分压(
的代数式表示,气体分压(![]() )=气体总压(
)=气体总压(![]() )X体积分数]。
)X体积分数]。
(5)CO可作某熔融盐电池的燃料,电解质为![]() 和
和![]() 的熔融盐混合物,空气与
的熔融盐混合物,空气与![]() 的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为________。
的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
⑴ 铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
⑵ 基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag(填“>”或“<”)。
⑶ [Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
⑷ 用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
⑸氯、铜两种元素的电负性如表:
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
CuCl属于________(填“共价”或“离子”)化合物。

⑹Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为_____(用含ρ、a的代数式表示,相对原子质量:Cu-64,Cl-35.5)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com