
【题目】“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。

②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】+248KJ/mol 乙 E 降温反应速率减小,又降温平衡逆向移动,CO浓度减小,所以为E点 大于 小于 温度一定时,加压平衡逆移,CH4转化率减小,所以p2大 16
【解析】
(1)①利用盖斯定律解题;
(2)①根据平衡点确定,当达到平衡时正逆速率比等于化学计量数之比,根据图可知,反应平衡时图中对应的点应为A和F点;降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,据此判断;
②压强为P2时,在y点反应未达到平衡,在x点达到平衡,则反应正向移动,所以v(正)大于v(逆);该反应正反应为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;在y点对应温度下的甲烷的平衡转化率为50%,列三行式计算Kp。
(1)①ⅠCH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
Ⅱ CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
Ⅲ CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
利用盖斯定律:Ⅰ-Ⅱ×4+Ⅲ×2,得CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) △H=+248KJ/mol
2CO(g)+2H2(g) △H=+248KJ/mol
答案:+248KJ/mol
(2)①反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) △H=+248KJ/mol平衡时图中对应的点应为A和F点,当达到平衡时正逆速率比等于化学计量数之比v正(CO2):v逆(CO)=1:2,确定v正(CO2)相对应的是图中曲线乙;降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,据此判断曲线甲对应的平衡点可能为E;
2CO(g)+2H2(g) △H=+248KJ/mol平衡时图中对应的点应为A和F点,当达到平衡时正逆速率比等于化学计量数之比v正(CO2):v逆(CO)=1:2,确定v正(CO2)相对应的是图中曲线乙;降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,据此判断曲线甲对应的平衡点可能为E;
答案:乙 E 降温反应速率减小,又降温平衡逆向移动,CO浓度减小,所以为E点
②压强为P2时,在y点反应未达到平衡,在x点达到平衡,则反应正向移动,所以v(正)大于v(逆);该反应正反应为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;
在p2对应温度下的甲烷的平衡转化率为50%,列三行式计算。
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始(mol/L) 1.0 1.0 0 0
转化(mol/L) 0.5 0.5 1 1
平衡(mol/L) 0.5 0.5 1 1
n(平衡)总=0.5+0.5+1+1=3mol
p2=6MPa:各种气体平衡后对应压强:CO2(g)与CH4(g)的分压均为6×0.5/3=1Mpa;CO和H2的分压均为:6×1/3=2Mpa;
所以平衡常数Kp=![]() =16;
=16;
答案:大于 小于 温度一定时,加压平衡逆移,CH4转化率减小,所以p2大 16


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列操作中,不会引起误差的是
A. 震荡时锥形瓶中液体溅出
B. 滴定管用蒸馏水洗后,直接注入标准液
C. 读数时开始仰视,终止时俯视
D. 锥形瓶中洗净后还留有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示原电池装置的叙述,正确的是
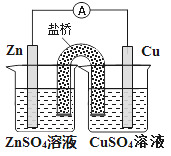
A. 铜是正极,铜片上有气泡产生
B. 锌片质量逐渐减少
C. 电子从铜片经导线流向锌片
D. 盐桥中阳离子向ZnSO4溶液移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A. 实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B. 金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C. 从卤水中(溶质主要是MgCl2)提取Mg
卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl(s)
MgCl(s) ![]() Mg
Mg
D. 由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下部分弱酸的电离常数如表。下列有关说法不正确的是

A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c( HCOOH)/c(HCOO-)=10
B. 相同pH的 HCOONa和NaClO溶液中离子总浓度前者大
C. 等浓度等体积的Na2S和 HCOOH混合后:c(Na+)=2c(HCOO-)+2c( HCOOH)
D. 向NaClO溶液中通入H2S发生的反应为ClO-+H2S![]() HS-+HClO
HS-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)![]() B(g) 2C(g)的平衡常数和温度的关系如下:
B(g) 2C(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1)该反应的平衡常数表达式K![]() ____________,
____________,![]() ______0(填“﹤”“﹥”或“≒”)
______0(填“﹤”“﹥”或“≒”)
(2)容积固定,判断该反应是否达到平衡的依据为_______(填正确选项前的字母)。
a.气体的密度不随时间改变
b.![]() (A)不随时间改变
(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变
d.压强不随时间改变
(3)1200℃时反应2C(g) ![]() A(g)
A(g)![]() B(g)的平衡常数值为____________。
B(g)的平衡常数值为____________。
(4)830℃时,向一个10.00L的密闭容器中充入0.40 mol的A和1.60 mol的B,如果反应初始2s内生成C的物质的量为0.40 mol,则2s内A的平均反应速率![]() (A)=____________
(A)=____________
mol·L-1·s-1;2s时![]() (B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
(B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相 中经自由基偶联反应生成乙烯,其反应如下:2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=_____________ (用含a.b.c.d的代数式表示)。

(1)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂 时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(选填“〉”、“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液在25 0C时pH=_______ (假设电解前后NaCl溶液的体积均为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (X)、
(X)、![]() (Y)互为同分异构体,下列说法不正确的是
(Y)互为同分异构体,下列说法不正确的是
A. Y的一氯代物只有三种
B. X的所有原子可能处于同一平面
C. X、Y与足量氢气完全加成时所需氢气的物质的量之比为1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《流浪地球》讲述了太阳即将爆发氦闪”(3He![]() C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
A. 核素![]() 的中子数比电子数多2
的中子数比电子数多2
B. 上述元素除氮之外仅能形成6种单质和4种氧化物
C. 碳、氢、氧元素组成的糖类物质均可发生水解
D. 上述元素组成的草酸亚铁(FeC2O4)中碳元素的化合价为+3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com