
����Ŀ�����ŵ�̼�ֵȽྻ�ּ����ķ�չ��![]() �ͻ���Ϻ�ˮ֮���������ѳ�Ϊ��ǰ��һ���о��ص㡣
�ͻ���Ϻ�ˮ֮���������ѳ�Ϊ��ǰ��һ���о��ص㡣
��ش��������⣺
��1���ճ�����������Ʒ������������ʴ��ԭ����________��
��2������̿ʵ�������£���̼ͬ�ز��ϵ�![]() �ͻ��������Һ֮��Ŀ��ܷ�Ӧ���£�
�ͻ��������Һ֮��Ŀ��ܷ�Ӧ���£�
��![]()
![]() ��
��
��![]()
![]() ��
��
��![]()
![]() ��
��
��![]() ��
��![]() ______
______![]() ��
��
��3��ʵ���¶��£�(![]() )/Feϵͳ�д��������Ӧ����
)/Feϵͳ�д��������Ӧ����![]() ������Һ�У�������Һ��ƽ������İٷֺ����Ķ���(lg[Al])��ƽ����(
������Һ�У�������Һ��ƽ������İٷֺ����Ķ���(lg[Al])��ƽ����(![]() )�İٷֺ����Ķ���(lg[
)�İٷֺ����Ķ���(lg[![]() ])��ϵ��ͼ��ʾ��ͼ���¶�
])��ϵ��ͼ��ʾ��ͼ���¶�![]() ___1973K(����>������<��).
___1973K(����>������<��).

��4������̿����£�̼��ʣʱ��̼��������Ӧ��Ҫ���ǣ�![]() ����ʵ�����о��÷�Ӧ��һ���¶���.��ij����ɱ�ĺ�ѹ�ܱ�����(��ѹǿΪ
����ʵ�����о��÷�Ӧ��һ���¶���.��ij����ɱ�ĺ�ѹ�ܱ�����(��ѹǿΪ![]() )����������̼��1mol
)����������̼��1mol![]() ��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��
��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��

��650��ʱ���÷�Ӧ�ﵽƽ������յ�������_____�����̼������Ϊ____��
��T��ʱ������ƽ����ϵ���ٳ���һ������V![]() )��V(
)��V(![]() )=5��4�Ļ�����壬ƽ��___(����������Ӧ�����������淴Ӧ��������������)�ƶ���
)=5��4�Ļ�����壬ƽ��___(����������Ӧ�����������淴Ӧ��������������)�ƶ���
��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��![]() =__[�ú�
=__[�ú�![]() �Ĵ���ʽ��ʾ�������ѹ(
�Ĵ���ʽ��ʾ�������ѹ(![]() )=������ѹ(
)=������ѹ(![]() )X�������]��
)X�������]��
��5��CO����ij�����ε�ص�ȼ�ϣ������Ϊ![]() ��
��![]() ���������������
�������λ���������![]() �Ļ����Ϊ��ȼ���������650���¹���ʱ�������ĵ缫��ӦʽΪ________��
�Ļ����Ϊ��ȼ���������650���¹���ʱ�������ĵ缫��ӦʽΪ________��
���𰸡�����Ʒ����Ϊһ�����ܵ�![]() ��Ĥ����ֹ���Ľ�һ������ -681.5 < 43.125kJ 3.0g ������Ӧ���� 23.04
��Ĥ����ֹ���Ľ�һ������ -681.5 < 43.125kJ 3.0g ������Ӧ���� 23.04![]()
![]()
��������
(1).�ճ�����������Ʒ������������ʴ����Ҫԭ������Ϊ����Ʒ������һ�����ܵ�����Ĥ![]() ��Ĥ������ֹ���Ľ�һ���������ʴ�Ϊ����Ʒ����Ϊһ�����ܵ�
��Ĥ������ֹ���Ľ�һ���������ʴ�Ϊ����Ʒ����Ϊһ�����ܵ�![]() ��Ĥ����ֹ���Ľ�һ��������
��Ĥ����ֹ���Ľ�һ��������
(2).������ʽ���б�ţ����ø�˹�����ҳ�Ŀ��ʽ������ʽ�Ĺ�ϵ��
��![]()
![]() ��
��
��![]()
![]() ��
��
��![]()
![]() ��
��
��![]() ��
��![]() ��/2-3��/2+3��/2= -681.5
��/2-3��/2+3��/2= -681.5![]()
�ʴ�Ϊ-681.5![]() ��
��
(3). ��ͼ�пɿ����������İٷֺ����Ķ���(lg[Al])һ��ʱ��![]() ʱ��ƽ����(
ʱ��ƽ����(![]() )�İٷֺ����Ķ���(lg[
)�İٷֺ����Ķ���(lg[![]() ])��1973Kʱ�ͣ�˵������
])��1973Kʱ�ͣ�˵������![]() ��һ���ȵĿ��淴Ӧ
��һ���ȵĿ��淴Ӧ![]() ʱƽ�������ƶ���˵��ͼ���¶�
ʱƽ�������ƶ���˵��ͼ���¶�![]() ��1973K���ʴ�Ϊ����
��1973K���ʴ�Ϊ����
(4). �ٴ�ͼ�У���֪��650��ʱ����Ӧ��ƽ��ʱ����CO���������Ϊ40%���跢����Ӧ��![]() ���ʵ���Ϊx���г�����ʽ
���ʵ���Ϊx���г�����ʽ
![]()
![]() ��
��
ʼ 1mol 0mol
ת xmol 2xmol
ƽ 1-xmol 2xmol
�ɵ�![]() �����ɵ�x=0.25mol��
�����ɵ�x=0.25mol��
�ʴ�ʱ��Ӧ���յ�����Ϊ0.25mol![]() 172.5
172.5![]() =43.125kJ��
=43.125kJ��
���̼������Ϊ12![]() ��0.25mol=3g��
��0.25mol=3g��
�ʴ�Ϊ43.125kJ��3.0g��
�� ��ͼ�п�֪��T���÷�Ӧ��ƽ��ʱ��V![]() )%=V(
)%=V(![]() )%����ƽ����ϵ��ƽ�ⳣ��K=1�����ٳ���һ������V
)%����ƽ����ϵ��ƽ�ⳣ��K=1�����ٳ���һ������V![]() )��V(
)��V(![]() )=5��4�Ļ�����壬��ʱ��ϵ�е�Qc=
)=5��4�Ļ�����壬��ʱ��ϵ�е�Qc=![]() ��K���ʷ�Ӧ��������Ӧ�����ƶ����ʴ�Ϊ������Ӧ�����ƶ���
��K���ʷ�Ӧ��������Ӧ�����ƶ����ʴ�Ϊ������Ӧ�����ƶ���
�� 925��ʱ��![]() ���������Ϊ96%����ʱ
���������Ϊ96%����ʱ![]() ���������Ϊ4%��������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��
���������Ϊ4%��������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��![]() =
= ![]() =23.04
=23.04![]() ���ʴ�Ϊ23.04
���ʴ�Ϊ23.04![]() ��
��
(5). CO��ȼ��ʱ����ԭ��ظ����Ϸ�����Ӧ����������Ϊ![]() ����ʱ�ĵ����Ϊ
����ʱ�ĵ����Ϊ![]() ��
��![]() �������λ����ʸ����ĵ缫��ӦʽӦдΪ
�������λ����ʸ����ĵ缫��ӦʽӦдΪ![]() ���ʴ�Ϊ
���ʴ�Ϊ![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ���ʵ��Ʊ�������������
A. ʵ���ҴӺ�������ȡ���ʵ�ȡ�����������ܽ�����������ȡ������
B. ���ʯ(��Ҫ�ɷ�TiO2)Ϊԭ����������Ti�����ʯ����̿![]() TiCl4
TiCl4![]() Ti
Ti
C. ��±ˮ��(������Ҫ��MgCl2)��ȡMg
±ˮ![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl(s)
MgCl(s) ![]() Mg
Mg
D. ��ʳ����ȡƯ�۾�NaCl(ag) ![]() Cl2
Cl2![]() Ư�۾�
Ư�۾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() (X)��
(X)��![]() (Y)��Ϊͬ���칹�壬����˵������ȷ����
(Y)��Ϊͬ���칹�壬����˵������ȷ����
A. Y��һ�ȴ���ֻ������
B. X������ԭ�ӿ��ܴ���ͬһƽ��
C. X��Y������������ȫ�ӳ�ʱ�������������ʵ���֮��Ϊ1��1
D. X��Y����ʹ���ˮ��Һ��ɫ������ɫ��ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��F�������ʵ���ɫ��Ӧ��Ϊ��ɫ��A��B��C��D�����ᷴӦ������E������B������һ�ֿ�ȼ���塣��C��D������һ����ɫ��ζ����H����������ʹ����ʯ��ˮ����ǡ�D��A�ɷ�Ӧ����C��F��HҲ�ɷ�Ӧ����C����һ����ɫ��ζ���塣
��ش��������⣺
��1��д��A��B��C��D��E��F�Ļ�ѧʽ
A________��B________��C________��D________��E________��F________��
��2��д��F��H��Ӧ�Ļ�ѧ����ʽ __________________________________��
��3��д�����з�Ӧ�����ӷ���ʽ��
��D������ ________________________________________________��
��B��ˮ _____________________________________________________��
��D��A ______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol/L��NaOH��Һ�ζ�ijŨ�ȵĶ�Ԫ����(![]() )��Һ��������Һ�и��ֺ�X���������ʵ�������(
)��Һ��������Һ�и��ֺ�X���������ʵ�������(![]() )��pH�ı仯������ͼ��ʾ������˵����ȷ����
)��pH�ı仯������ͼ��ʾ������˵����ȷ����

A. ![]() �ĵ��볣��
�ĵ��볣��![]() ��
�� ![]() ��ˮ�ⳣ��
��ˮ�ⳣ��![]()
B. ��ˮ�������c(![]() )��a>b
)��a>b
C. ����![]() �ֱ��ʾ
�ֱ��ʾ![]() (
(![]() )��
)��![]() (HX-)�ı仯
(HX-)�ı仯
D. b����ʾ��Һ�У�c(![]() >3c(
>3c(![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��CH3COOH�ĵ��볣��Ka=1.8��10-5��������,��25ml�������Ʊ���Һ����μ���0.2 mol��L��1��CH3COOH��Һ��pH�仯��������ͼ��ʾ��
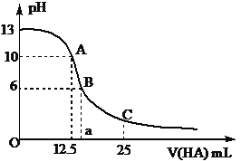
��1��������������Һ�����ʵ���Ũ��Ϊ________mol��L��1��
��2��A���Ӧ������Ϊ12.5ml�������û����Һ����ˮ�������c(OH��)��____ mol��L��1��
��3��B����ʾ��Һ�У�c(CH3COO��)��c(Na��)��_______________ mol��L��1(�ȷֵ)��c(CH3COO��)/c(CH3COOH)��_______��
��4��C����ʾ��Һ�У�c(CH3COOH)_______c(CH3COO��)��(������������������������)
��5����300 mL����NaOH��Һ��ͨ��448 mL CO2(��״��)���壬��ַ�Ӧ����Һ������Ũ�ȹ�ϵ��ȷ����________.
A��c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B��2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C��c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D��c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӱ�����˵�������̫����������������(3He![]() C)���������̫��ϵ�ļ�������.̫����������ռ71%����26%������̼������Ԫ��ռ2%����.����˵����ȷ����
C)���������̫��ϵ�ļ�������.̫����������ռ71%����26%������̼������Ԫ��ռ2%����.����˵����ȷ����
A. ����![]() ���������ȵ�������2
���������ȵ�������2
B. ����Ԫ�س���֮������γ�6�ֵ��ʺ�4��������
C. ̼���⡢��Ԫ����ɵ��������ʾ��ɷ���ˮ��
D. ����Ԫ����ɵIJ�������(FeC2O4)��̼Ԫ�صĻ��ϼ�Ϊ+3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������ȼ�����ʾ��ͼ���¡��õ���ܷ�ӦΪ��PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ������˵������ȷ����

A. Ca�缫����������Ӧ
B. �����ĵ缫��Ӧ��Ca(s)+2Cl����2e��= CaCl2(s)
C. ���� LiCl �� KCl ˮ��Һ������ˮ LiCl��KCl
D. ����ˮLiCl��KCl������������ں��ز��ܹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú����ҵ�����е�SO2���γ��������Ҫԭ������SO2�Ǽ��������γɵ���Ч����������������⣺
��1����֪��4FeS2��s��+11O2��g���T2Fe2O3��s��+8SO2��g����H����3412.0kJmol��1
Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H����25.0 kJmol��1
2C��s��+O2��g���T2CO��g����H����221.0 kJmol��1
��2FeS2��s��+7O2��g��+3C��s���T2Fe��s��+3CO2��g��+4SO2��g����H��_____kJmol��1��
��2������NaClO2��Һ����
SO2�����NaClO2��Һ��Ӧ�����ӷ���ʽΪ2SO2+ClO2��+4OH��2SO42��+C1��+2H2O����֪pc����lgc��SO2�����ڸ��������У�����SO2�ķ���ͨ�����NaClO2��Һ�У����pc���¶ȵĹ�ϵ��ͼ��ʾ��
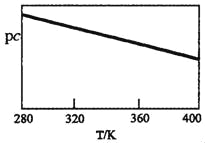
��ͼ������֪��������Ӧ��_____��Ӧ�����������������������������¶Ȳ��䣬����ѹǿ��������Ӧ��ƽ�ⳣ��K_____������������������С����������������
��3��ȼ��ϸ������
�ٺ�FeS2��ȼú��������������˾���T��f�������������ݾ���L��f������������˾���T��t���������������������ͼ��ʾ��
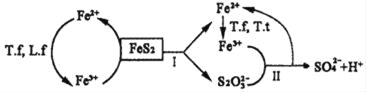
��֪�������ܷ�ӦΪ��FeS2+14Fe3++8H2O�T2SO42��+15Fe2++16H+��
��Ӧ�Ļ�ѧ����ʽΪ��FeS2+6Fe3++3H2O�TS2O32��+7Fe2++6H+��
д����Ӧ�Ļ�ѧ����ʽ_____��
������������Ӧ�У�����������˾���T��f����Fe3+���γɹ��̿���Ϊ��ͼ��ʾ��ԭ��أ�

��ϸ��ĤΪ_____�����������ӽ���Ĥ�����������ӽ���Ĥ�������õ�ص������缫��ӦʽΪ_____���÷����ڸ���������Ч�ʴ�ͣ�ԭ����_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com