
【题目】对于可逆反应N2(气)+3H2(气)![]() 2NH3(气) ΔH<0,下列说法正确的是( )
2NH3(气) ΔH<0,下列说法正确的是( )
A.达到平衡时反应物和生成物浓度一定相等
B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大
C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动
D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率
科目:高中化学 来源: 题型:
【题目】下列离子能大量共存的是( )
A.含大量H+的溶液中:CrO42-、Cl-、NO3-、Na+
B.含大量AlO2-的溶液中:Na+、K+、NO3-、HCO3-
C.含大量Al3+的溶液中:Na+、K+、NO3-、ClO-
D.含大量CH3COO-的溶液中:NH4+、Cl-、F-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2。 请回答下列问题:
(1)①、②、③、④四种物质中常用作还原剂的有(填序号)。
(2)请将③、④、⑤、⑥对应物质填入下列横线上,以组成一个氧化还原反应化学方程式: +=+
(3)随着人们环保意识的增强,许多汽车都已经装上了如图所示的尾气处理装置。在催化剂的作用下,尾气中两种主要的有毒气体反应生成两种无害气体,两种无害气体均为空气中的成分,写出该反应的化学方程式: 。该反应中是氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
(1)一定温度下,向固定体积为2L的密闭容器中充入SO2和NO2各1mol,发生反应SO2(g)+NO2(g)SO3(g)+NO(g),测得上述反应5min末到达平衡,此时容器中NO与NO2的体积比为3:1,则这段时间内SO2的反应速率υ(SO2)= , 此反应在该温度下的平衡常数K= .
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: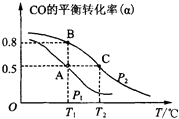
①上述合成甲醇的反应为反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 . A、B两点对应的压强大小关系是PAPB(填“大于”、“小于”或“等于”).
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 , 理论上通过外电路的电子最多为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一体积为2 L的密闭容器中,通入112 g N2和24 g的H2 , 此时容器内压强为p大气压。在该温度和催化剂作用下,H2和N2反应达到平衡,测得平衡时压强为0.95p大气压,下列说法不正确的是( )
A.平衡时,N2物质的量是3.6 mol
B.平衡时,H2的物质的量是10.8 mol
C.平衡时,N2的转化率10%
D.NH3的体积百分含量是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( ) 
A.反应的化学方程式为A(g)+B(g)D(g)
B.反应开始到10s,用B表示的反应速率为0.079mol/(Ls)
C.在10s时,D的体积分数为71.8%
D.反应开始到10s时,A的转化率为79%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2。 请回答下列问题:
(1)①、②、③、④四种物质中常用作还原剂的有(填序号)。
(2)请将③、④、⑤、⑥对应物质填入下列横线上,以组成一个氧化还原反应化学方程式: +=+
(3)随着人们环保意识的增强,许多汽车都已经装上了如图所示的尾气处理装置。在催化剂的作用下,尾气中两种主要的有毒气体反应生成两种无害气体,两种无害气体均为空气中的成分,写出该反应的化学方程式: 。该反应中是氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料一 NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:2NH3+3CuO ![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
材料二 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+=Cu2++Cu+H2O。
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是________。
A.加热氯化铵固体,再通过碱石灰
B.在N2和H2的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过碱石灰
D.在生石灰中加入浓氨水,再通过碱石灰
(2)为证明NH3还原CuO的反应中有水生成,B中应放入的试剂是。
(3)当观察到(填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1∶4的稀硫酸作试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1∶4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有。
可证明还原产物中含有Cu2O的操作及现象是。
(5)请写出A中生成Cu2O的化学方程式。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
(1)该反应的正反应是热反应,且m+np (填“>”、“<”或“=”).
(2)增大压强时,B的转化率(填“增大”、“减小”或“不变”,下同),逆反应速率 .
(3)若加入C(体积不变),则A的体积分数 .
(4)若降低温度,则平衡时B、C的浓度之比 ![]() 比值将 .
比值将 .
(5)若加入催化剂,该反应的反应热 .
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色(填“变浅”、“变深”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com