
����Ŀ���������������ǵĽ���ϢϢ��أ�Ŀǰ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2��CO������3���е���Ⱦ�
��1��һ���¶��£���̶����Ϊ2L���ܱ������г���SO2��NO2��1mol��������ӦSO2��g��+NO2��g��SO3��g��+NO��g�������������Ӧ5minĩ����ƽ�⣬��ʱ������NO��NO2�������Ϊ3��1�������ʱ����SO2�ķ�Ӧ���ʦԣ�SO2��= �� �˷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K= ��
��2���״�������Ϊ��Ҫ���л�ȼ�ϣ�ͨ������CO��H2�ϳɼ״����䷴Ӧ�Ļ�ѧ����ʽΪCO��g��+2H2��g��CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10mol CO��20mol H2���ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��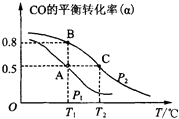
�������ϳɼ״��ķ�ӦΪ��Ӧ������ȡ������ȡ�����
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ �� A��B�����Ӧ��ѹǿ��С��ϵ��PAPB������ڡ�����С�ڡ����ڡ�����
�������ﵽƽ��״̬Aʱ���ɵļ״����ڹ��ɼ״�һ����ȼ�ϵ�أ��������ҺΪKOHŨ��Һ����õ�ع���ʱ�����ĵ缫��ӦʽΪ �� ������ͨ�����·�ĵ������Ϊ mol��
���𰸡�
��1��0.075mol/��L?min����9
��2��KA=KB��KC��KA=KB��KC��С�ڣ�O2+2H2O+4e��=4OH����30
���������⣨1����μӷ�Ӧ��SO2Ϊnmol
SO2��g�� | + | NO2��g�� | = | SO3��g�� | + | NO��g�� | |
��Ӧǰ��mol�� | 1 | 1 | 0 | 0 | |||
��Ӧ�ˣ�mol�� | n | n | n | n | |||
5minĩ��mol�� | 1��n | 1��n | n | n |
![]() =
= ![]() ����ã�n=
����ã�n= ![]() =0.75
=0.75
�ԣ�SO2��= ![]() =0.075mol/��Lmin��
=0.075mol/��Lmin��
���������2L��������Ե�Ũ�ȴ������K
K= ![]() =9
=9
���Դ��ǣ�0.075mol/��Lmin����9��
��2.���ٴ�ͼ�Ͽɼ�����P2ʱ�����¶ȵ�����CO��ת����Խ��Խ�ͣ��ɼ�������ʱƽ���������ƶ�������������ԭ��������Ӧ���ȣ�
���Դ��ǣ����ȣ�
�ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�÷�Ӧ���ȣ��¶�Խ��ƽ�������ƶ���Kֵ��С������ѹǿ��ƽ�������ƶ���CO��ת��������֪PA С��PB ��
���Դ��ǣ�KA=KB��KC��С�ڣ�
��ȼ�ϵ�ص���������������Ӧ���ڼ�����������ˮ����������������
O2+2H2O+4e��=4OH��
A��CO��ƽ��ת����50%���μӷ�Ӧ��COΪ��10mol��50%=5mol
��CO��g��+2H2��g��=CH3OH��g������������CH3OHҲΪ5mol��CH3OHȼ�����ɶ�����̼��ˮ��ֻ��C�ļ�̬�ө�2��Ϊ+4��H��O��̬û�䣬����1molCH3OHȼ��ת��6mol���ӣ���5molCH3OH��Ӧת�Ƶ���Ϊ��5��6=30��
���Դ��ǣ�O2+2H2O+4e��=4 OH����30��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ��������ȼ�ϣ���CO��H2��CH4�ȣ���������Ӧ������Ӧ�����Ļ�ѧ��ת��Ϊ���ܵ�װ�ã�ͨ��������������Ϊ�������Һ��������й��ڼ��飨CH4��ȼ�ϵ�ص���գ�
��1��������������Ӧ�Ļ�ѧ����ʽΪ��________.
��2����֪ȼ�ϵ�ص��ܷ�ӦʽΪCH4+2O2+2KOH�TK2CO3+3H2O���������һ���ĵ缫��ӦΪCH4+10OH����8e���TCO32��+7H2O������缫��ȼ�ϵ�ص����������������������һ���缫�ϵĵ缫��ӦʽΪ��
��3�����ŵ�ز��Ϸŵ磬�������Һ�ļ��������������С�����䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м�������������
A. ����ˮ���𱽺ͼ�ϩ B. ��������Һ����������ȩ
C. �ý����Ƽ����Ҵ������� D. ��̼������Һ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3 �� ��������SiO2��Fe2O3��MgO����ҵ�ϴ�����������ȡ���ɲ�����ͼ��ʾ�������̣� 
��ش��������⣺
��1��ͼ���漰������Һ�������ʵ�鷽��������������ƣ�����Ҫ�õ��IJ��� ��������
��2������B�ijɷ������ѧʽ����ͬ��������C�ijɷ�������
��3��д��������ҺD�����ӷ���ʽ��
��4������Fת��Ϊ����M�Ļ�ѧ����ʽΪ����ҺD��ͨ�����CO2���ɳ���F�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ��ʱ���������ɵ��ǣ� ��
A. ������̼ B. ˮ C. һ����̼ D. �Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(g)��3H2(g) ![]() 2NH3(g)����H��0������˵����ȷ����(����)
2NH3(g)����H��0������˵����ȷ����(����)
A.�ﵽƽ��ʱ��Ӧ���������Ũ��һ�����
B.���º�ѹʱ�ﵽƽ�����백�������´ﵽƽ��ʱ��������Ũ�ȱ�ԭƽ��ʱ��С
C.�ﵽƽ��ʱ�������¶ȼӿ������ȷ�Ӧ�����ʣ������˷��ȷ�Ӧ�����ʣ����Է�Ӧ���淴Ӧ�ķ����ƶ�
D.��������������̵���ƽ���ʱ�䣬������Ϊ�ӿ�������Ӧ�����ʣ����������淴Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(��)��3H2(��)![]() 2NH3(��)����H<0������˵����ȷ����(����)
2NH3(��)����H<0������˵����ȷ����(����)
A.�ﵽƽ��ʱ��Ӧ���������Ũ��һ�����
B.�ﵽƽ�����백�������´ﵽƽ��ʱ��������Ũ�ȱ�ԭƽ��ʱ��
C.�ﵽƽ��ʱ�������¶ȼӿ������ȷ�Ӧ�����ʣ������˷��ȷ�Ӧ�����ʣ�����ƽ�����淴Ӧ�ķ����ƶ�
D.��������������̵���ƽ���ʱ�䣬������Ϊ�ӿ�������Ӧ�����ʣ����������淴Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. NH4+�ļ��飺��������������Һ�����ȣ���ʪ�����ɫʯ����ֽ���Թܿڼ���
B. ��ҵ�ϳɰ��ķ�Ӧ�У����������������������ȫ��Ӧ
C. ʯ��ʯ��ϡ����ܳ�������������̼
D. �γ���Ȫ��ԭ��һ�����ڲ���ѹǿ����������ѹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��÷���ʯ[Ca5(PO4)3F]Ϊԭ�ϣ�������ͼ��ʾ������ȡ���ᡢ�ع������[Ca(H2PO4)2]������ᡣͼ�з�Ӧ(��)Ϊ����ʯ����һ��ԭ�Ϸ�Ӧ������A��B��C�������ʣ����еIJ���C�ָ�����ʯ������Ӧ(��)������B���ع�����ơ�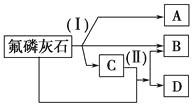
��д��������Ӧ�Ļ�ѧ����ʽ����Ӧ(��)����Ӧ(��)��
��������Ҫ�ر�ע��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com